Natrit: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (41 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: Hans-Jürgen [[Benutzer:Hschwarz|Schwarz]], Nils Mainusch | |||
Autoren: Hans-Jürgen [[Benutzer:Hschwarz|Schwarz]], Nils Mainusch | |||
<br>zurück zu [[SalzWiki:Carbonate |Carbonate]] | <br>zurück zu [[SalzWiki:Carbonate |Carbonate]] | ||
{{Infobox_Salz | {{Infobox_Salz | ||
|Footnote=<ref>http://webmineral.com/data/Natrite.shtml</ref><ref>http://www.mindat.org/min-2849.html</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Natrit</ref> | |Footnote=<ref>http://webmineral.com/data/Natrite.shtml</ref><ref>http://www.mindat.org/min-2849.html</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Natrit</ref> | ||
| Zeile 9: | Zeile 9: | ||
|Trivialname = | |Trivialname = | ||
|chemFormel =Na<sub>2</sub>CO<sub>3</sub> | |chemFormel =Na<sub>2</sub>CO<sub>3</sub> | ||
|Hydratformen =Natriumcarbonathydrat (Na<sub>2</sub>CO<sub>3</sub>•H<sub>2</sub>O)<br>Natriumcarbonatheptahydrat (Na<sub>2</sub>CO<sub>3</sub>•7H<sub>2</sub>O)<br>Natriumcarbonatdecahydrat (Na<sub>2</sub>CO<sub>3</sub>•10H<sub>2</sub>O) | |Hydratformen =Natriumcarbonathydrat - [[Thermonatrit]] (Na<sub>2</sub>CO<sub>3</sub>•H<sub>2</sub>O)<br>Natriumcarbonatheptahydrat (Na<sub>2</sub>CO<sub>3</sub>•7H<sub>2</sub>O)<br>Natriumcarbonatdecahydrat - [[Natron]] (Na<sub>2</sub>CO<sub>3</sub>•10H<sub>2</sub>O) | ||
| | |Kristallsystem =monoklin | ||
|Deliqueszenzfeuchte = | |Deliqueszenzfeuchte = | ||
|Löslichkeit= | |Löslichkeit=210 g/l | ||
|Dichte =2,532 g/cm<sup>3</sup> | |Dichte =2,532 g/cm<sup>3</sup> | ||
|Molvolumen = | |Molvolumen = | ||
| Zeile 27: | Zeile 27: | ||
|Phasenübergang = | |Phasenübergang = | ||
|chemVerhalten =in wässriger Lösung alkalisch,<br> pH ≈ 12 | |chemVerhalten =in wässriger Lösung alkalisch,<br> pH ≈ 12 | ||
|Bemerkungen = | |Bemerkungen =blüht schnell in trockener Luft aus und geht in das Monohydrat über; <br>ph ca. 12 | ||
|Literatur = | |||
}} | }} | ||
<!-- | <!-- | ||
| Zeile 42: | Zeile 43: | ||
== Angaben zu Herkunft und Bildung von Natrit an Baudenkmalen == | == Angaben zu Herkunft und Bildung von Natrit an Baudenkmalen == | ||
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, können im mineralischen System eines Baudenkmals Natriumcarbonate als Ausblühsalze entstehen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch kann 1 Gramm Na<sub>2</sub>O ca. 4,6 Gramm Natriumcarbonatdekahydrat bilden. Enthält beispielsweise ein Portlandzement lediglich 0,1% Na<sub>2</sub>O, so können etwa 0,45 kg Natriumcarbonate pro 100 kg Zement entstehen <bib id=Arnold.etal:1991/>. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendete Restaurierungsprodukte (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächen-wasser anzuführen, die Na<sup>+</sup>-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen. | Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, können im mineralischen System eines Baudenkmals Natriumcarbonate als Ausblühsalze entstehen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch kann 1 Gramm Na<sub>2</sub>O ca. 4,6 Gramm Natriumcarbonatdekahydrat bilden. Enthält beispielsweise ein Portlandzement lediglich 0,1% Na<sub>2</sub>O, so können etwa 0,45 kg Natriumcarbonate pro 100 kg Zement entstehen <bib id="Arnold.etal:1991"/>. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendete Restaurierungsprodukte (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächen-wasser anzuführen, die Na<sup>+</sup>-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen. | ||
== Angaben zum Schadenspotential und zur Verwitterungsaktivität von Natrit == | == Angaben zum Schadenspotential und zur Verwitterungsaktivität von Natrit == | ||
| Zeile 55: | Zeile 56: | ||
=== Hygroskopizität === | === Hygroskopizität === | ||
Die Abschätzung der Hygroskopizität von in situ vorliegenden Natriumcarbonaten ist schwierig, da die Lage des Sorptionspunktes und des Sättigungswertes unter dem Einfluß von lokalen Begebenheiten (Fremdionen, vorliegende Hydratstufen, Temperaturverhältnisse) sehr stark variiert. Nachstehend finden sich Angaben der Deliqueszenzfeuchte von | Die Abschätzung der Hygroskopizität von in situ vorliegenden Natriumcarbonaten ist schwierig, da die Lage des Sorptionspunktes und des Sättigungswertes unter dem Einfluß von lokalen Begebenheiten (Fremdionen, vorliegende Hydratstufen, Temperaturverhältnisse) sehr stark variiert. Nachstehend finden sich Angaben der Deliqueszenzfeuchte von Natrit in Abhängigkeit von der Umgebungstemperatur (vgl. Tabelle [[Gleichgewichtsfeuchte in Abhängigkeit von Temperatur]]): | ||
{| cellspacing=" | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="40%" align="left" class="wikitable sortable" | |||
|+''Tabelle 1: Deliqueszenzfeuchte von Natrit [nach <bib id="Arnold.etal:1991"/>]'' | |||
|- | |- | ||
| | |bgcolor = "#F0F0F0" align=center| '''15°C''' | ||
| | |bgcolor = "#F0F0F0" align=center| '''20°C''' | ||
| | |bgcolor = "#F0F0F0" align=center| '''25°C''' | ||
| | |bgcolor = "#F0F0F0" align=center| '''30°C''' | ||
|- | |- | ||
| | |bgcolor = "#FFFFEO" align=center| 96,5% r.F. | ||
| | |bgcolor = "#FFFFEO" align=center| 97,9% r.F. | ||
| | |bgcolor = "#FFFFEO" align=center| 88,2% r.F. | ||
| | |bgcolor = "#FFFFEO" align=center| 83,2% r.F. | ||
|} | |} | ||
<br clear="all"> | |||
=== Kristallisationsdruck === | === Kristallisationsdruck === | ||
Bei der Kristallisation aus wäßriger Lösung läßt sich für Thermonatrit ein Kristallisationsdruck von 28,0-33,3 N/mm<sup>2</sup>, für Natrit 7,8-9,2 N/mm<sup>2</sup> angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm<sup>2</sup>) <bib id=Winkler:1975/>. | Bei der Kristallisation aus wäßriger Lösung läßt sich für Thermonatrit ein Kristallisationsdruck von 28,0-33,3 N/mm<sup>2</sup>, für Natrit 7,8-9,2 N/mm<sup>2</sup> angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm<sup>2</sup>) <bib id="Winkler:1975"/>. | ||
=== Hydratationsverhalten === | === Hydratationsverhalten === | ||
| Zeile 93: | Zeile 87: | ||
=== Hydratationsdruck === | === Hydratationsdruck === | ||
Zur Gruppe der verwitterungsaktiven Salze werden Natrit und Thermonatrit aufgrund der Eigenschaft gezählt, einen häufigen Umbau ihrer Kristallstruktur durch Veränderungen des Kristallwassergehaltes zu durchlaufen. Erklärung findet dies in den niedrigen Hydratations- bzw. Übergangstemperaturen, die, wie oben angegeben, im Bereich um 35°C liegen. Der Übergang von Thermonatrit zu Natrit und damit verbunden der Einbau von 9 Wassermolekülen in das Kristallgitter ist mit einer Volumenzunahme von rund 260% verbunden. Der Hydratationsdruck, der beim Übergang von Thermonatrit zum Natriumcarbonatheptahydrat (bei einer Temperatur von 0-20°C und einer r.F. von ca. 80%) aufgebaut wird, kann mit Zahlenwerten zwischen 28,4 –63,7 N/mm<sup>2</sup> angegeben werden <bib id=Stark.etal:1996/> (oder 1993 prüfen?). | Zur Gruppe der verwitterungsaktiven Salze werden Natrit und Thermonatrit aufgrund der Eigenschaft gezählt, einen häufigen Umbau ihrer Kristallstruktur durch Veränderungen des Kristallwassergehaltes zu durchlaufen. Erklärung findet dies in den niedrigen Hydratations- bzw. Übergangstemperaturen, die, wie oben angegeben, im Bereich um 35°C liegen. Der Übergang von Thermonatrit zu Natrit und damit verbunden der Einbau von 9 Wassermolekülen in das Kristallgitter ist mit einer Volumenzunahme von rund 260% verbunden. Der Hydratationsdruck, der beim Übergang von Thermonatrit zum Natriumcarbonatheptahydrat (bei einer Temperatur von 0-20°C und einer r.F. von ca. 80%) aufgebaut wird, kann mit Zahlenwerten zwischen 28,4 –63,7 N/mm<sup>2</sup> angegeben werden <bib id="Stark.etal:1996"/> (oder 1993 prüfen?). | ||
<!-- === Umwandlungsreaktionen === --> | <!-- === Umwandlungsreaktionen === --> | ||
| Zeile 126: | Zeile 120: | ||
*parallele/symmetrische Auslöschung<br> | *parallele/symmetrische Auslöschung<br> | ||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="80%" align="left" class="wikitable" | |||
{| cellspacing=" | |+''Tabelle 3: Salzphasen, die teils gleiche Eigenschaften aufweisen und möglicherweise zu verwechseln wären'' | ||
|- | |- | ||
| '''Salzphase''' | |bgcolor = "#F0F0F0"| '''Salzphase''' | ||
| | |bgcolor = "#F0F0F0"| '''Unterscheidungsmerkmale zu Thermonatrit''' | ||
|- | |- | ||
| Nesquehonit | |bgcolor = "#F7F7F7"| '''Nesquehonit''' MgCO<sub>3</sub> •<sub> </sub>3H<sub>2</sub>O; | ||
| schwer wasserlöslich / schiefe Auslöschung | |bgcolor = "#FFFFEO"| schwer wasserlöslich / schiefe Auslöschung | ||
|- | |- | ||
| Lansfordit | |bgcolor = "#F7F7F7"| '''Lansfordit''' MgCO<sub>3</sub> • 5H<sub>2</sub>O | ||
| schwer wasserlöslich / schiefe Auslöschung / niedrige Doppelbrechung | |bgcolor = "#FFFFEO"| schwer wasserlöslich / schiefe Auslöschung / niedrige Doppelbrechung | ||
|- | |- | ||
| Trona | |bgcolor = "#F7F7F7"| '''Trona''' Na<sub>3</sub>H(CO<sub>3</sub>)<sub>2</sub> • 2H<sub>2</sub>O | ||
| zumeist ein beobachtbarer Index > 1,53 / schiefe Auslöschung | |bgcolor = "#FFFFEO"| zumeist ein beobachtbarer Index > 1,53 / schiefe Auslöschung | ||
|- | |- | ||
| Pottasche | |bgcolor = "#F7F7F7"| '''Pottasche''' K<sub>2</sub>CO<sub>3</sub> | ||
| | |bgcolor = "#FFFFEO"| zumeist ein beobachtbarer Index > 1,53 / schiefe Auslöschung / stark hygroskopisch | ||
|} | |} | ||
<br clear=all> | |||
=== Raman-Spektrum === | |||
[[file:Na2CO3.png|Raman Spektrum von Natrit - M. Steiger , K. Linnow <ref>http://www.chemie.uni-hamburg.de/ac/AKs/Steiger/Raman%_Data%_Base/Na2CO3.htm</ref>: Bruker Senterra, 532 nm, 20 mW]] | |||
<br clear=all> | |||
<!-- | <!-- | ||
=== Röntgendiffraktometrie === | === Röntgendiffraktometrie === | ||
== DTA / TG === | == DTA / TG === | ||
| Zeile 156: | Zeile 156: | ||
== Umgang mit Natritschäden == --> | == Umgang mit Natritschäden == --> | ||
==Natrit im Bild == | ==Natrit im Bild == | ||
| Zeile 192: | Zeile 193: | ||
== Weblinks == | == Weblinks == | ||
<references/ | <references/> | ||
== Literatur == | == Literatur == | ||
< | <biblist /> | ||
[[Category:Natrit]] [[Category:Carbonat]] [[Category:Salz]] [[Category: | [[Category:Natrit]] [[Category:Carbonat]] [[Category:Salz]] [[Category:Schwarz,Hans-Jürgen]] [[Category:R-MSteiger]] [[Category:Review]][[Category:Liste]] | ||
Aktuelle Version vom 16. Februar 2015, 21:46 Uhr
Autoren: Hans-Jürgen Schwarz, Nils Mainusch
zurück zu Carbonate
| Natrit[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Natrit |
| Chemische Bezeichnung | Natriumcarbonat |
| Trivialname | |
| Chemische Formel | Na2CO3 |
| Hydratformen | Natriumcarbonathydrat - Thermonatrit (Na2CO3•H2O) Natriumcarbonatheptahydrat (Na2CO3•7H2O) Natriumcarbonatdecahydrat - Natron (Na2CO3•10H2O) |
| Kristallsystem | monoklin |
| Deliqueszenzfeuchte 20°C | |
| Löslichkeit(g/l) bei 20°C | 210 g/l |
| Dichte (g/cm³) | 2,532 g/cm3 |
| Molares Volumen | |
| Molare Masse | 105,99 g/mol |
| Transparenz | |
| Spaltbarkeit | gut |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | in wässriger Lösung alkalisch, pH ≈ 12 |
| Bemerkungen | blüht schnell in trockener Luft aus und geht in das Monohydrat über; ph ca. 12 |
| Kristalloptik | |
| Brechungsindices | nx = 1,415 ny = 1,535 nz = 1,546 |
| Doppelbrechung | Δ = 0,131 |
| Optische Orientierung | zweiachsig negativ |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
Vorkommen von Natrit[Bearbeiten]
Natürliche Vorkommen von Natriumcarbonaten finden sich in festen Salzablagerungen, in Salzseen, sogenannten Natron-Seen, wie dem Magadi-See in Ostafrika oder dem Owens Lake in Kalifornien. Weiterhin existieren alkalische Quellen mit variierendem Gehalt an natürlichem Natriumcarbonat. Zur Gewinnung sind unterschiedliche technische Verfahren entwickelt worden, in denen durch Lösungs-, Reinigungs- und Eindampfprozesse reines Natriumcarbonat erzeugt werden kann.
Angaben zu Herkunft und Bildung von Natrit an Baudenkmalen[Bearbeiten]
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, können im mineralischen System eines Baudenkmals Natriumcarbonate als Ausblühsalze entstehen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch kann 1 Gramm Na2O ca. 4,6 Gramm Natriumcarbonatdekahydrat bilden. Enthält beispielsweise ein Portlandzement lediglich 0,1% Na2O, so können etwa 0,45 kg Natriumcarbonate pro 100 kg Zement entstehen [Arnold.etal:1991]Titel: Monitoring Wall Paintings Affected by soluble Salts
Autor / Verfasser: Arnold, Andreas; Zehnder, Konrad . Eine Fülle von Reinigungsmaterialien und v.a. früher verwendete Restaurierungsprodukte (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächen-wasser anzuführen, die Na+-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen.
. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendete Restaurierungsprodukte (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächen-wasser anzuführen, die Na+-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem Natriumchlorid. In Küstennähe ist NaCl-haltiges Meerwasser als Natriumquelle zu berücksichtigen.
Angaben zum Schadenspotential und zur Verwitterungsaktivität von Natrit[Bearbeiten]
Lösungsverhalten[Bearbeiten]
Die drei an Bauwerken nachgewiesenen Natriumcarbonate besitzen eine hohe Wasserlöslichkeit, wodurch prinzipiell eine große Mobilität der Salze verbunden ist. Herauszuheben ist die große Temperaturabhängigkeit der Lösungseigenschaften bei Thermonatrit und Natrit. Die starke Temperaturabhängigkeit der Löslichkeit der Natriumcarbonat kann zur Folge haben, dass in Wasser gelöstes Natrit bei Abfall der Umgebungstemperatur durch Übersättigung der Lösung ausfällt, auch wenn die Feuchteverhältnisse konstant bleiben.
Diagramm 1 – Darstellung der temperaturabhängigen Veränderung der Löslichkeit von Thermonatrit und Natrit im Vergleich mit anderen Salzphasen (Löslichkeitsangaben nach Schwarz und Stark/Stürmer 1993).
Hygroskopizität[Bearbeiten]
Die Abschätzung der Hygroskopizität von in situ vorliegenden Natriumcarbonaten ist schwierig, da die Lage des Sorptionspunktes und des Sättigungswertes unter dem Einfluß von lokalen Begebenheiten (Fremdionen, vorliegende Hydratstufen, Temperaturverhältnisse) sehr stark variiert. Nachstehend finden sich Angaben der Deliqueszenzfeuchte von Natrit in Abhängigkeit von der Umgebungstemperatur (vgl. Tabelle Gleichgewichtsfeuchte in Abhängigkeit von Temperatur):
| 15°C | 20°C | 25°C | 30°C |
| 96,5% r.F. | 97,9% r.F. | 88,2% r.F. | 83,2% r.F. |
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wäßriger Lösung läßt sich für Thermonatrit ein Kristallisationsdruck von 28,0-33,3 N/mm2, für Natrit 7,8-9,2 N/mm2 angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm2) [Winkler:1975]Titel: Stone: Properties, Durability in Man ´s Environment
Autor / Verfasser: Winkler, Erhard M. .
.
Hydratationsverhalten[Bearbeiten]
Das System Na2CO3 und H2O:
Bei der Betrachtung des Systems Na2CO3 und H2O sind drei stabile Hydratwasserstufen zu unterscheiden, die an Bauwerken nachgewiesen wurden und zwar ein 10-Hydrat (Natriumcarbonatdekahydrat), ein 7-Hydrat (Natriumcarbonatheptahydrat) und das 1-Hydrat (Natriumcarbonatmonohydrat). Die unterschiedlichen Natriumcarbonat-Hydrate sind herstellbar, indem eine Ausscheidung des Produktes aus einer übersättigten, wäßrigen Lösung bei bestimmten Temperaturen initiiert wird. So entsteht das Natriumcarbonatdekahydrat, wenn der Kristallausfall bei einer Temperatur von unter 32°C stattfindet, der Ausfall bei einer Temperatur zwischen 32°C und 35,4°C führt zur Bildung von Natriumcarbonatheptahydrat, eine Lösungstemperatur von über 35,4°C führt zum Entstehen des Monohydrates, also Thermonatrit. Diese Temperaturwerte werden als Übergangstemperatur bezeichnet. Wasserfreies Natriumcarbonat kann durch Trocknung der bezeichneten Hydratstufen bei ca. 98°C erhalten werden, geht bei Raumtemperatur und normalen Luftfeuchteverhältnissen allerdings rasch in Thermonatrit und/oder andere Hydratstufen über. Das im engen Temperaturbereich zwischen 32°C und 35,4°C aus übersättigter Lösung herstellbare Heptahydrat ist, gleich der wasserfreien Form, in üblichen klimatischen Verhältnissen vergleichsweise instabil und in der Regel ein Übergangsprodukt beim Wechsel des stabileren Thermonatrit zu Natrit oder umgekehrt.
Hydratationsdruck[Bearbeiten]
Zur Gruppe der verwitterungsaktiven Salze werden Natrit und Thermonatrit aufgrund der Eigenschaft gezählt, einen häufigen Umbau ihrer Kristallstruktur durch Veränderungen des Kristallwassergehaltes zu durchlaufen. Erklärung findet dies in den niedrigen Hydratations- bzw. Übergangstemperaturen, die, wie oben angegeben, im Bereich um 35°C liegen. Der Übergang von Thermonatrit zu Natrit und damit verbunden der Einbau von 9 Wassermolekülen in das Kristallgitter ist mit einer Volumenzunahme von rund 260% verbunden. Der Hydratationsdruck, der beim Übergang von Thermonatrit zum Natriumcarbonatheptahydrat (bei einer Temperatur von 0-20°C und einer r.F. von ca. 80%) aufgebaut wird, kann mit Zahlenwerten zwischen 28,4 –63,7 N/mm2 angegeben werden [Stark.etal:1996]Titel: Bauschädliche Salze
Autor / Verfasser: Stark, Jochen; Stürmer, Sylvia (oder 1993 prüfen?).
(oder 1993 prüfen?).
Analytischer Nachweis[Bearbeiten]
Die Identifikation von Thermonatrit und Natrit kann vor Ort durch einfache Lösungsversuche und die pH-Wertmessung beginnen: Nach Bläuer Böhm ist Natrit das einzige bisher bekannte Ausblühsalz, welches mit einem pH-Wert deutlich über 8 sowohl alkalisch ist als auch die Eigenschaft aufweist, sich bei leichter Erwärmung im eigenen Kristallwasser zu lösen. Analog weist am Objekt vorliegendes Thermonatrit einen deutlich im alkalischen Bereich liegenden pH-Wert auf. Das Lösungsverhalten in Wasser ist gut. In wasserfreiem Ethanol ist Thermonatrit nicht löslich.
Mikroskopie
[Bearbeiten]
Laboruntersuchung:
Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu überprüfen. Thermonatrit und Natrit
besitzen eine deutliche Tendenz zur Ausbildung nadeliger und/oder dendritischer Kristallformen bei der Rekristallisation. Sofern Gips im Probematerial vorliegt, kommt es zum raschen Ausfall von Calciumcarbonat, was sich in Form eines weißlichen Niederschlages darstellt.
Brechungsindizes: nx = 1.420; ny = 1.509; nz = 1,525;
Doppelbrechung: Δ = max. 0,105
Kristallklasse: orthorhombisch
Polarisationsmikroskopische Untersuchung:
In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Ausgangsprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockner Luft (mit r.F. < ca. 60%) wird nach kurzer Zeit vorwiegend Thermonatrit vorliegen.
Die Zuweisung der Brechungsindizes von Thermonatrit erfolgt entsprechend der Immersionsmethode. Einzelpartikel, die in Standard-Immersionsöl mit einem Brechungsindex nD = 1,518 eingebettet werden, zeigen bei der Rotation in polarisiertem Durchlicht einen starken Wechsel [Blaeuer-Boehm:1994]Titel: Salzuntersuchungen an Baudenkmälern
Autor / Verfasser: Bläuer-Böhm, Christine , a.a.O., S. 86 ff. im Relief. Aufgrund der hohen Doppelbrechung weisen Thermonatritkristalle lebhafte Interferenzfarben auf. Hierin liegt ein klares Unterscheidungsmerkmal zu Natrit, welches eine deutlich geringe maximale Doppelbrechung besitzt.
, a.a.O., S. 86 ff. im Relief. Aufgrund der hohen Doppelbrechung weisen Thermonatritkristalle lebhafte Interferenzfarben auf. Hierin liegt ein klares Unterscheidungsmerkmal zu Natrit, welches eine deutlich geringe maximale Doppelbrechung besitzt.
Thermonatrit wird in das System der orthorhombischen Kristalle eingeordnet. Damit verbunden ist das Auftreten paralleler und/oder symmetrischer Auslöschung. Voluminösere Kristallnadeln löschen in der Regel vollständig aus. Die Auslöschung tritt „scharf“ ein.
Verwechslungsmöglichkeiten:
Thermonatrit ist eindeutig zuweisbar, wenn folgende Untersuchungskriterien geklärt sind:
- hoher pH-Wert
- gute Wasserlöslichkeit
- charakteristischer Habitus
- alle Brechungsindizes unter nD=1,53
- hohe Doppelbrechung
- parallele/symmetrische Auslöschung
| Salzphase | Unterscheidungsmerkmale zu Thermonatrit |
| Nesquehonit MgCO3 • 3H2O; | schwer wasserlöslich / schiefe Auslöschung |
| Lansfordit MgCO3 • 5H2O | schwer wasserlöslich / schiefe Auslöschung / niedrige Doppelbrechung |
| Trona Na3H(CO3)2 • 2H2O | zumeist ein beobachtbarer Index > 1,53 / schiefe Auslöschung |
| Pottasche K2CO3 | zumeist ein beobachtbarer Index > 1,53 / schiefe Auslöschung / stark hygroskopisch |
Raman-Spektrum[Bearbeiten]
Natrit im Bild[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Na2CO3 aus wässriger Lösung auf einem Objektträger
- Na2CO3 aus wässriger Lösung auf einem Objektträger
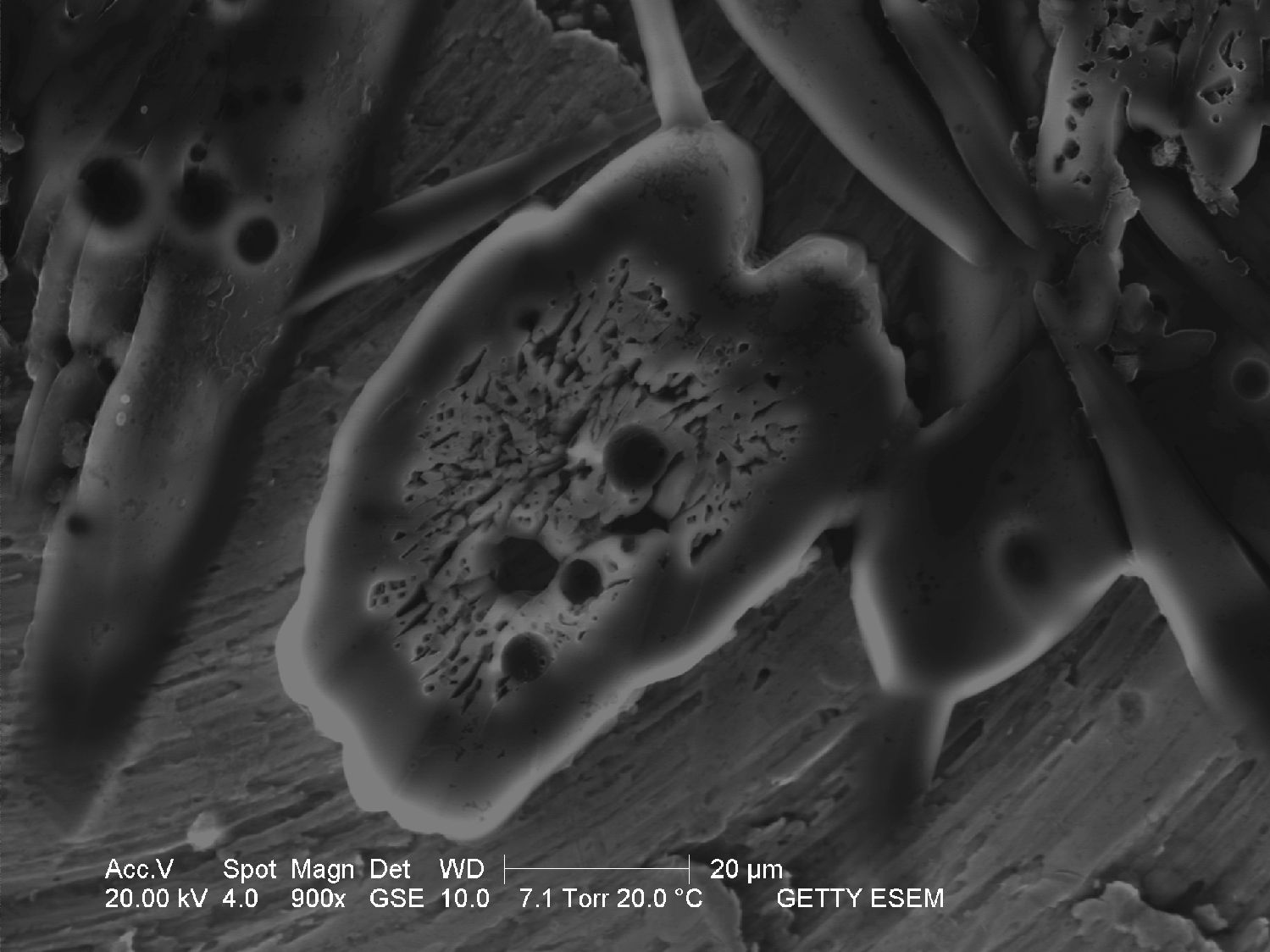
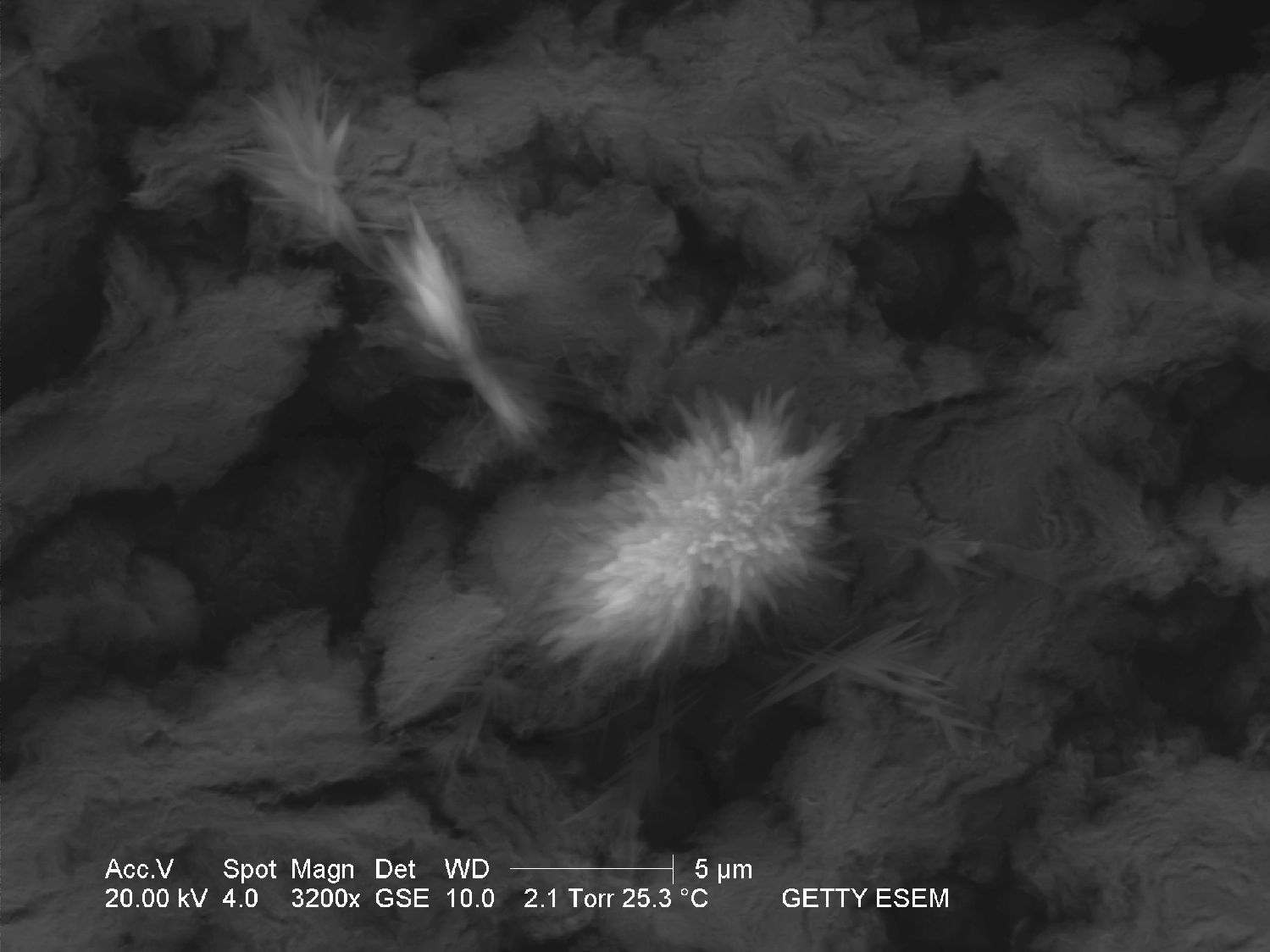
Unter dem Rasterelektronenmikroskop[Bearbeiten]
- Aufnahme mit einem ESEM
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Arnold.etal:1991] | Arnold, Andreas; Zehnder, Konrad (1991): Monitoring Wall Paintings Affected by soluble Salts. In: Cather, Sharon (Hrsg.): The Conservation of Wall Paintings: Proceedings of a symposium organized by the Coutrauld Institut of Art and the Getty Conservation Institute, London, July 13-16, The Getty Conservation Institute, 103-136, Webadresse. |  |
| [Blaeuer-Boehm:1994] | Bläuer-Böhm, Christine (1994): Salzuntersuchungen an Baudenkmälern. In: Zeitschrift für Kunsttechnologie und Konservierung, 8 (1), 86-103 |  |
| [Stark.etal:1996] | Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
| [Winkler:1975] | Winkler, Erhard M. (1975): Stone: Properties, Durability in Man ´s Environment, Springer Verlag, Wien |  |
![Raman Spektrum von Natrit - M. Steiger , K. Linnow [4]: Bruker Senterra, 532 nm, 20 mW](https://repository.hawk-hhg.de/images/5/5b/Na2CO3.png)