Calciumnitrat: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (5 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
zurück zu [[Nitrate]] | zurück zu [[Nitrate]] | ||
{{Infobox_Salz | {{Infobox_Salz | ||
| Zeile 40: | Zeile 39: | ||
==Löslichkeit== | ==Löslichkeit== | ||
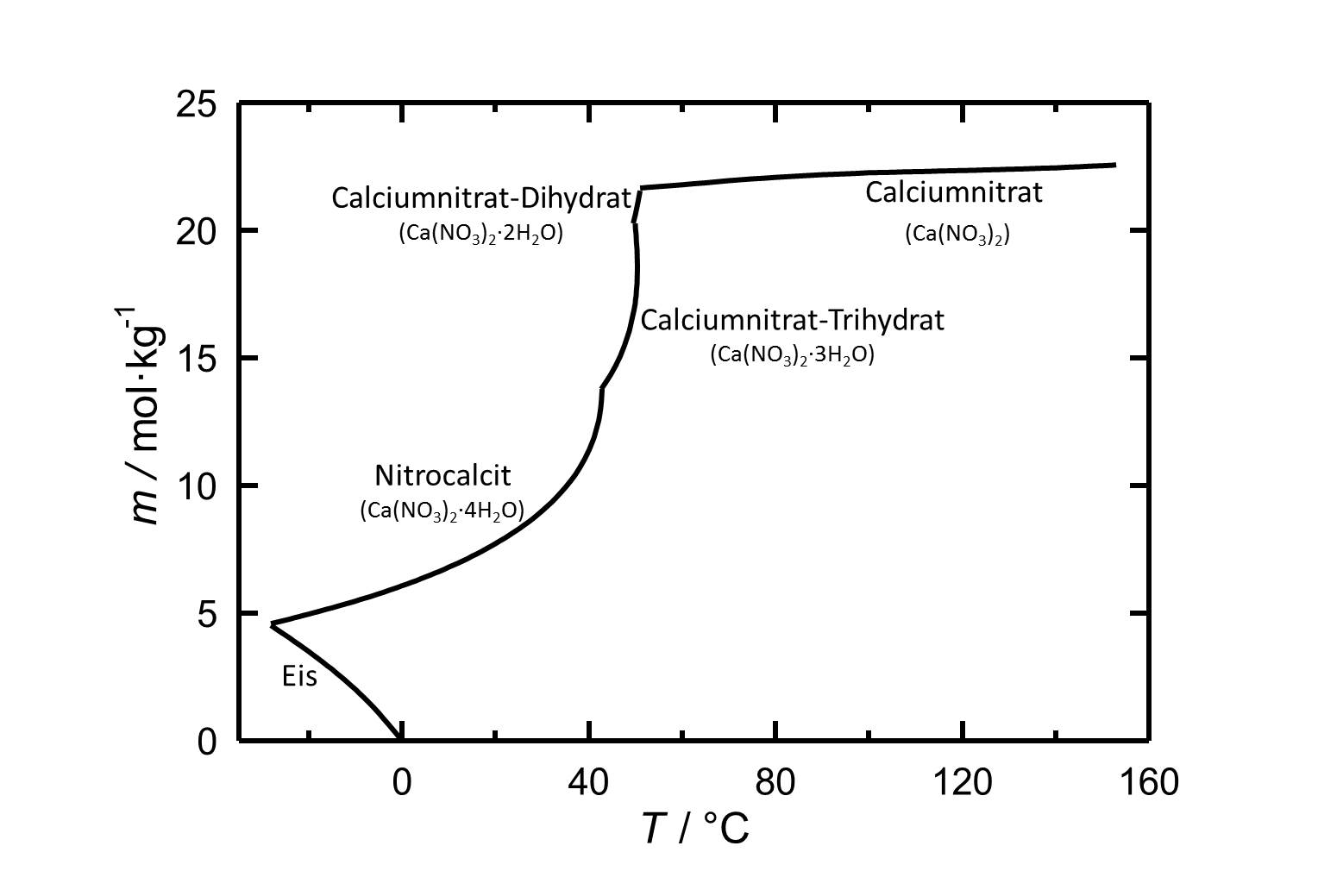
[[Image:Loeslichkeit von Calciumnitrat in Wasser.jpg|thumb|left| | [[Image:Loeslichkeit von Calciumnitrat in Wasser.jpg|thumb|left|800px|Abbildung 1: Löslichkeit von Calciumnitrat in Wasser, aufgetragen ist die Molalität ''m'' [n(Ca(NO<sub>3</sub>)<sub>2</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] | ||
<br clear=all> | |||
Unter Standardbedingungen, also bei einer Temperatur von 25 °C und einem Druck von einem bar, liegt das Tetrahydrat des Calciumnitrats [[Nitrocalcit]] vor. Mit seiner relativ hohen Löslichkeit in Wasser, gehört das Salz zu den gut löslichen Salzen. In dem Löslichkeitsdiagramm ist die starke Temperaturabhängigkeit der Löslichkeit erkennbar, so dass diese mit steigender Temperatur ebenfalls zunimmt. Bei Temperaturen von ca. 43 °C, 49,5 °C und 51 °C erfolgen die | Unter Standardbedingungen, also bei einer Temperatur von 25 °C und einem Druck von einem bar, liegt das Tetrahydrat des Calciumnitrats [[Nitrocalcit]] vor. Mit seiner relativ hohen Löslichkeit in Wasser, gehört das Salz zu den gut löslichen Salzen. In dem Löslichkeitsdiagramm ist die starke Temperaturabhängigkeit der Löslichkeit erkennbar, so dass diese mit steigender Temperatur ebenfalls zunimmt. Bei Temperaturen von ca. 43 °C, 49,5 °C und 51 °C erfolgen die jeweiligen Dehydratisierungen zum Tri- und Dihydrat, sowie anschließend zum wasserfreien Calciumnitrat. | ||
==Hygroskopizität== | ==Hygroskopizität== | ||
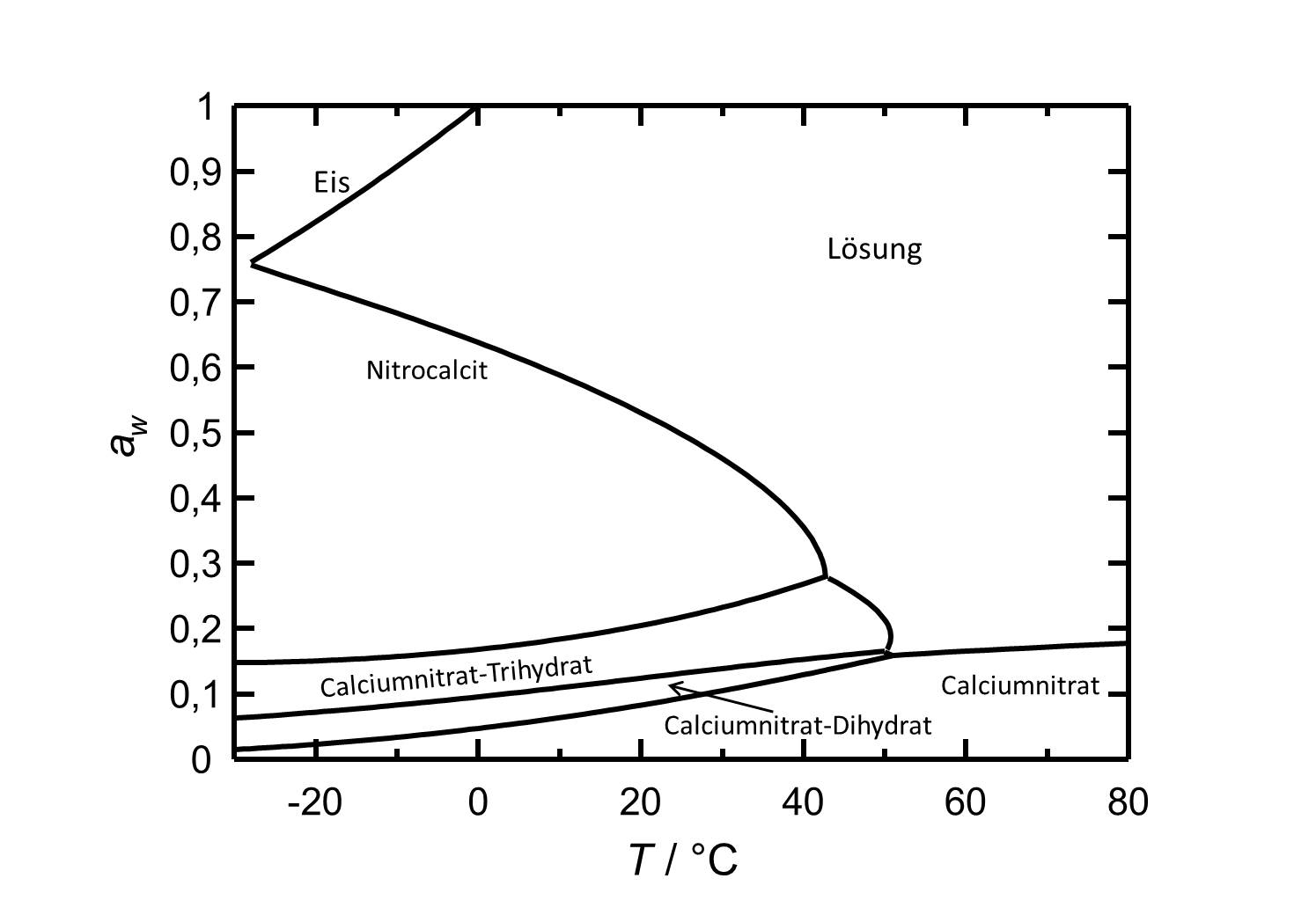
[[Image:Del Ca(NO3)2 d.jpg|thumb| | [[Image:Del Ca(NO3)2 d.jpg|thumb|left|800px|Abbildung 2: Deliqueszenzverhalten von Calciumnitrat in Abhängigkeit der Temperatur. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur.]] | ||
<br clear=all> | |||
Calciumnitrat gehört zu den hygroskopischen Salzen. Bei einer Temperatur von 25 °C weist das unter diesen Bedingungen vorliegende [[Nitrocalcit]] eine Deliqueszenzfeuchte von ca. 50 % auf. Die Phasenumwandlugen von Nitrocalcit zu den beiden weiteren Hydratstufen und zum wasserfreien Calciumnitrat erfolgen erst bei relativen Luftfeuchtigkeiten von 22 %, 13 % | Calciumnitrat gehört zu den hygroskopischen Salzen. Bei einer Temperatur von 25 °C weist das unter diesen Bedingungen vorliegende [[Nitrocalcit]] eine Deliqueszenzfeuchte von ca. 50 % auf. Die Phasenumwandlugen von Nitrocalcit zu den beiden weiteren Hydratstufen und zum wasserfreien Calciumnitrat erfolgen erst bei relativen Luftfeuchtigkeiten von 22 %, 13 % beziehungsweise 9 %. | ||
==Weblinks== | ==Weblinks== | ||
<references/> | |||
==Literatur== | ==Literatur== | ||
Aktuelle Version vom 25. Februar 2015, 20:19 Uhr
Autor: Amelie Stahlbuhk
zurück zu Nitrate
| Calciumnitrat | |
| Mineralogische Salzbezeichnung | Calciumnitrat |
| Chemische Bezeichnung | Calciumnitrat |
| Trivialname | |
| Chemische Formel | Ca(NO3)2 |
| Hydratformen | Ca(NO3)2•2H2O (Calciumnitrat-Dihydrat) Ca(NO3)2•3H2O (Calciumnitrat-Trihydrat) Ca(NO3)2•4H2O (Nitrocalcit) |
| Kristallsystem | |
| Deliqueszenzfeuchte 20°C | |
| Löslichkeit(g/l) bei 20°C | |
| Dichte (g/cm³) | 2,483 g/cm3 |
| Molares Volumen | 66,09 cm3/mol |
| Molare Masse | 164,09 g/mol |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | |
| Kristalloptik | |
| Brechungsindices | |
| Doppelbrechung | |
| Optische Orientierung | |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| [Robie.etal:1978]Titel: Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures Autor / Verfasser: Robie R.A., Hemingway B.S.; Fisher J.A. 
| |
Abstract[Bearbeiten]
Das Salz Calciumnitrat wird vorgestellt und seine Eigenschaften, sowie die der weiteren Hydratstufen, in Bezug auf Löslichkeit und Hygroskopizität werden erläutert.
Löslichkeit[Bearbeiten]
Unter Standardbedingungen, also bei einer Temperatur von 25 °C und einem Druck von einem bar, liegt das Tetrahydrat des Calciumnitrats Nitrocalcit vor. Mit seiner relativ hohen Löslichkeit in Wasser, gehört das Salz zu den gut löslichen Salzen. In dem Löslichkeitsdiagramm ist die starke Temperaturabhängigkeit der Löslichkeit erkennbar, so dass diese mit steigender Temperatur ebenfalls zunimmt. Bei Temperaturen von ca. 43 °C, 49,5 °C und 51 °C erfolgen die jeweiligen Dehydratisierungen zum Tri- und Dihydrat, sowie anschließend zum wasserfreien Calciumnitrat.
Hygroskopizität[Bearbeiten]
Calciumnitrat gehört zu den hygroskopischen Salzen. Bei einer Temperatur von 25 °C weist das unter diesen Bedingungen vorliegende Nitrocalcit eine Deliqueszenzfeuchte von ca. 50 % auf. Die Phasenumwandlugen von Nitrocalcit zu den beiden weiteren Hydratstufen und zum wasserfreien Calciumnitrat erfolgen erst bei relativen Luftfeuchtigkeiten von 22 %, 13 % beziehungsweise 9 %.
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Robie.etal:1978] | Robie R.A., Hemingway B.S.; Fisher J.A. (1978): Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures. In: U.S. Geol. Surv. Bull, 1452 () |  |