Magnesiumsulfat: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (7 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
# | Autoren: [[Benutzer:AStahlbuhk|Amelie Stahlbuhk]] | ||
<br> | |||
zurück zu [[Sulfate]] | |||
{{Baustelle}} | |||
==Absract== | |||
Die verschiedenen Hydratformen des Magnesiumsulfats sollen vorgestellt werden, sowie ihr Verhalten bezüglich Löslichkeit und Hygroskopizität. | |||
==Hydratformen== | |||
Es gibt mehrere Hydratformen des Magnesiumsulfats, wobei wasserfreies Magnesiumsulfat nicht in der Natur vorkommt.<br> | |||
[[Kieserit]] MgSO<sub>4</sub>•H<sub>2</sub>O <br> | |||
[[Sanderit]] MgSO<sub>4</sub>•2H<sub>2</sub>O <br> | |||
[[Starkeyit]] MgSO<sub>4</sub>•4H<sub>2</sub>O <br> | |||
[[Pentahydrit]] MgSO<sub>4</sub>•5H<sub>2</sub>O <br> | |||
[[Hexahydrit]] MgSO<sub>4</sub>•6H<sub>2</sub>O <br> | |||
[[Epsomit]] MgSO<sub>4</sub>•7H<sub>2</sub>O <br> | |||
[[Meridianiit]] MgSO<sub>4</sub>•11H<sub>2</sub>O <br> | |||
==Lösungsverhalten== | |||
Die Magnesiumsulfathydratformen gehören zu den leichtlöslichen Salzen (s. Tabelle). Mit der hohen Löslichkeit ist auch eine hohe Mobilität in porösen Materialien verbunden. | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="30%" align="left" class="wikitable" | |||
|+''Tabelle 1: Löslichkeiten in mol/kg verschiedener Magnesiumsulfathydratformen bei 20°C [nach <bib id="Steiger.etal:2011a"/>].'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| '''Hydratform''' | |||
|bgcolor = "#F0F0F0" align=center| '''Löslichkeit [mol/kg] bei 20°C''' | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Kieserit]] | |||
|bgcolor = "#FFFFEO" align=center| 5,60 | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Starkeyit]] | |||
|bgcolor = "#FFFFEO" align=center| 5,04 | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Pentahydrit]] | |||
|bgcolor = "#FFFFEO" align=center| 4,40 | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Hexahydrit]] | |||
|bgcolor = "#FFFFEO" align=center| 3,61 | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Epsomit]] | |||
|bgcolor = "#FFFFEO" align=center| 2,84 | |||
|} | |||
<br clear="all"> | |||
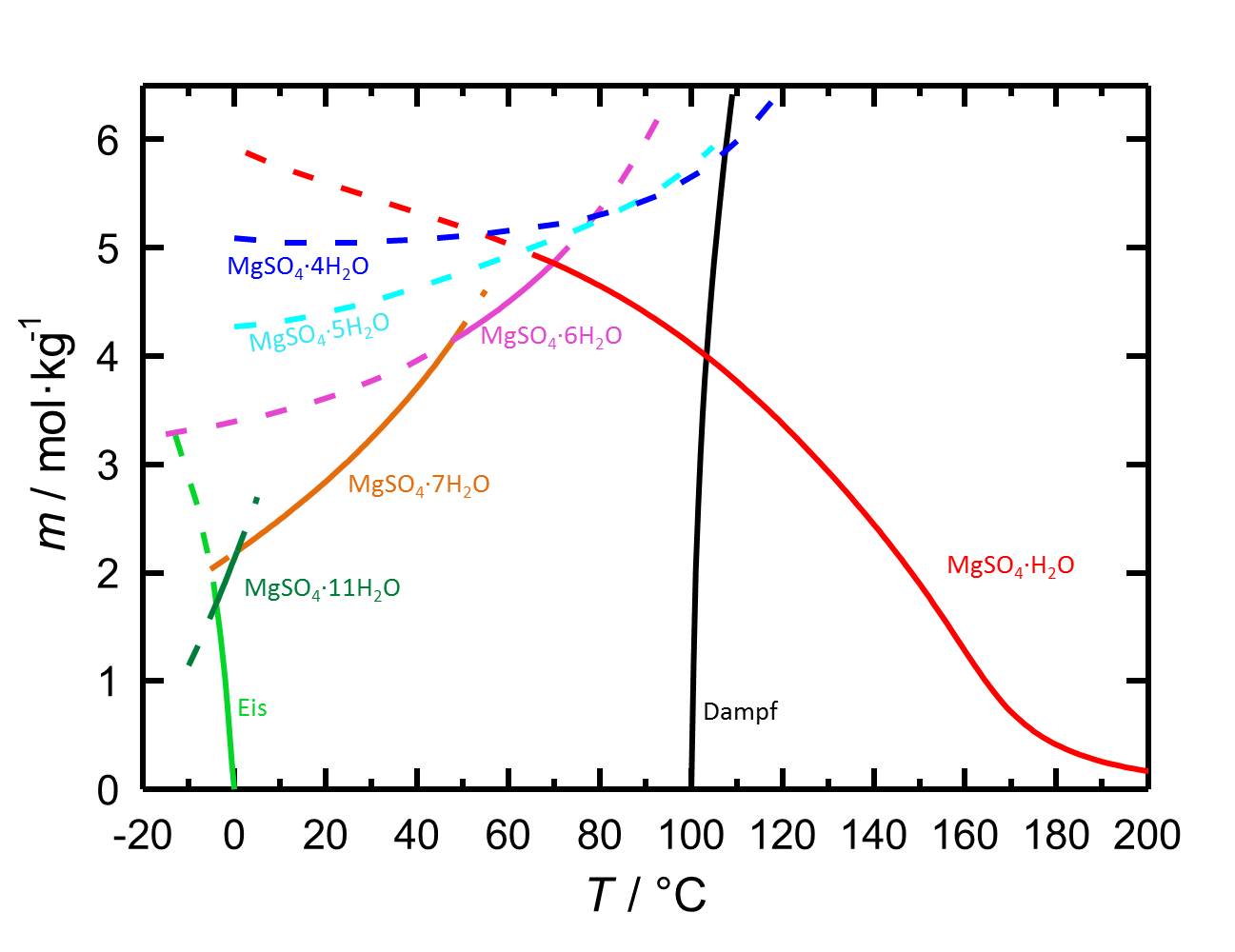
Das Löslichkeitsdiagramm des MgSO<sub>4</sub>-H<sub>2</sub>O-Systems enthält aufgrund der verschiedenen Hydratstufen, mit sowohl stabilen als auch mit metastabilen Gleichgewichten, mehr Inhalte als jene von Salzen mit weniger oder keinen Hydratstufen. Die Temperaturabhängigkeit der Löslichkeit führt dazu, dass mit Temperaturänderungen gegebenenfalls die Hydratation oder die Dehydratation einer betrachteten Phase einhergeht. | |||
<br clear="all"> | |||
[[File:L MgSO4.jpg|thumb|778px|left|'''Abbildung 1:''' Löslichkeiten im System MgSO<sub>4</sub>-H<sub>2</sub>O in Abhängigkeit der Temperatur. Aufgetragen ist die Molalität ''m'' [n(MgSO<sub>4</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur, wobei die Gleichgewichte der verschiedenen Hydratformen durch unterschiedliche Farben der Kurven gekennzeichnet sind. Gestrichelte Kurven markieren metastabile Gleichgewichte. Neben den Löslichkeiten sind ebenfalls Gefrier- und Siedepunkte angegeben. Nach <bib id="Steiger.etal:2011a"/>.]] | |||
<br clear="all"> | |||
==Hygroskopizität== | |||
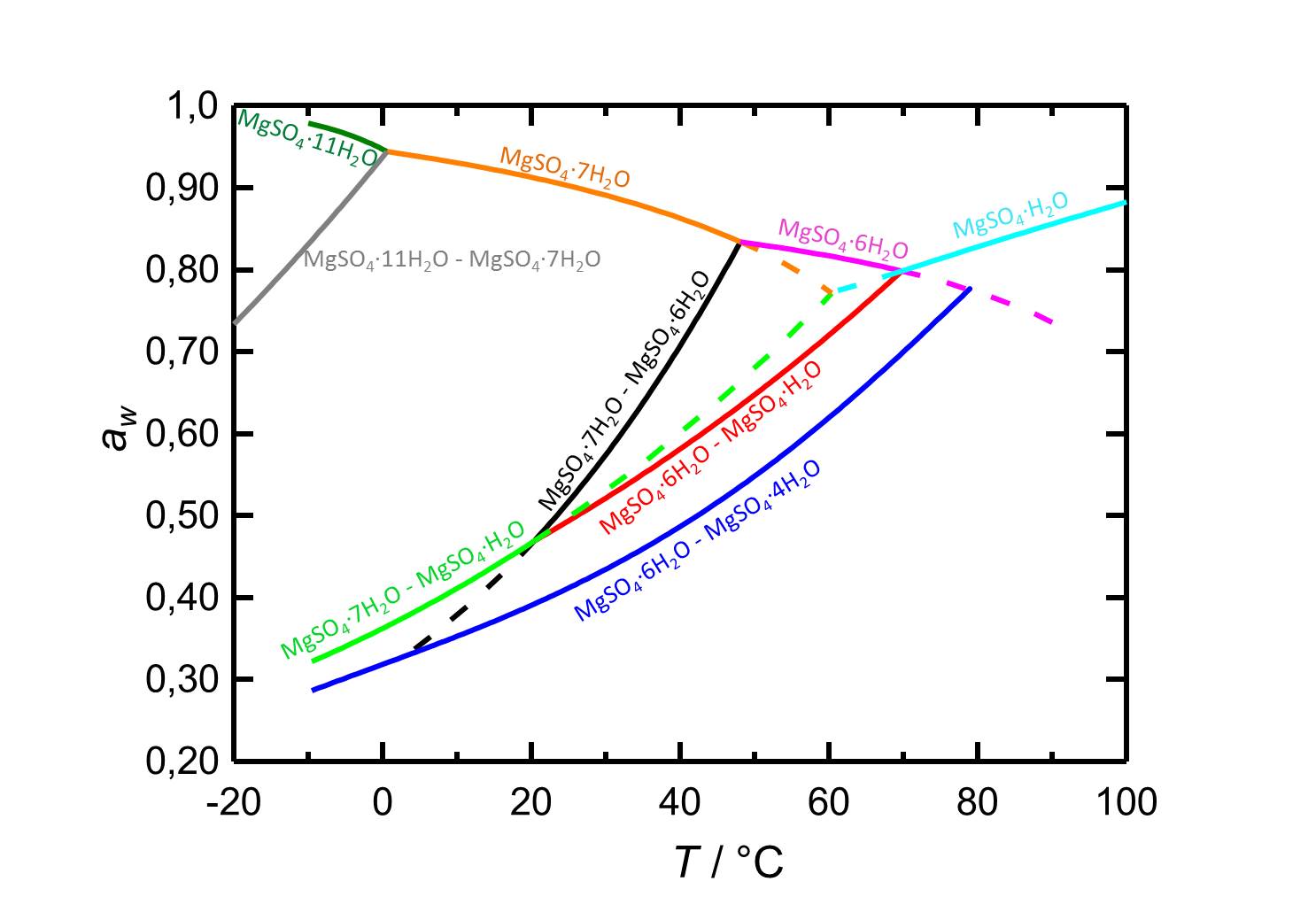
Je nach Temperatur oder relativer Luftfeuchte kann es bei Änderungen dieser Variablen im System MgSO<sub>4</sub>-H<sub>2</sub>O zur Hydratation oder zur Dehydratation beziehungsweise zur Deliqueszenz oder Kristallisation kommen. Bei einer Temperatur von 20 °C ist Epsomit unterhalb seiner Deliqueszenzfeuchte von 91,3 % die vorliegende kristalline Phase. Ab einer relativen Luftfeuchte von etwa 47 % kommt es zur Dehydratation des Salzes zu nierdrigeren Hydratstufen, wie es die Kurven der Gleichgewichtskurven in Abbildung 2 zeigen. | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="30%" align="left" class="wikitable" | |||
|+''Tabelle 2: Deliqueszenz- und Gleichgewichtsfeuchten bei 20 °C [nach <bib id="Steiger.etal:2011a"/>].'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| '''Betrachtete Phasenübergänge''' | |||
|bgcolor = "#F0F0F0" align=center| '''Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C''' | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Epsomit]]-Lösung | |||
|bgcolor = "#FFFFEO" align=center| 91,3 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Epsomit]]-[[Hexahydrit]] | |||
|bgcolor = "#FFFFEO" align=center| 46,6 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Epsomit]]-[[Kieserit]] | |||
|bgcolor = "#FFFFEO" align=center| 46,7 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Hexahydrit]]-[[Starkeyit]] | |||
|bgcolor = "#FFFFEO" align=center| 39,1 % | |||
|} | |||
<br clear="all"> | |||
<br clear="all"> | |||
[[File:D MgSO4 deutsch.jpg|thumb|800px|left|'''Abbildung 2:''' Deliqueszenzverhalten des Systems MgSO<sub>4</sub>-H<sub>2</sub>O in Abhängingkeit der Temperatur. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur. Gleichgewichtsfeuchten und Deliqueszenzfeuchten der verschiedenen Phasen sind durch unterschiedliche Farben gekennzeichnet. Gestrichelte Kurven markieren metastabile Gleichgewichte. Nach <bib id="Steiger.etal:2011a"/>.]] | |||
<br clear="all"> | |||
Im Temperaturbereich von -10 bis 100 °C liegen die Deliqueszenzfeuchten der je nach Temperatur vorliegenden Hydratstufen stets oberhalb von 80 % r.F., so dass sie eine geringe Hygroskopizität aufweisen. | |||
<!-- | |||
== Hydratationsverhalten == | |||
Das System MgSO<sub>4</sub>–H<sub>2</sub>O: Als stabile Verbindungen sind die oben aufgelisteten sechs Hydratstufen des Magnesiumsulfats belegt. Mit der Ausnahme des Magnesiumsulfat-12-Hydrates wurden alle oben aufgeführten Kristallwasserstufen des Magnesiumsulfates an Baudenkmalen nachgewiesen, wobei im wesentlichen jedoch nur [[Epsomit]], [[Hexahydrit]], [[Pentahydrit]] und [[Kieserit]] auftreten. | |||
Epsomit stellt bei Raumtemperatur und einer relativen Feuchte im Bereich von 50%-90% die beständigste Hydratstufe dar. Sinkt die relative Feuchte bei Raumtemperatur deutlich unter 50%, dann kommt es zu Kristallwasserabgabe und der Bildung niedrigerer Hydratstufen. [[Hexahydrit]] (MgSO<sub>4</sub><sub></sub>•6H<sub>2</sub>O) ist als Reinsalz theoretisch nur im Temperaturbereich zwischen ca. 48°C und 67,5 °C stabil. [[Pentahydrit]] wird in der Literatur als an der Luft metastabil, bzw. instabil bezeichnet, trotzdem ist die Existenz dieser beiden Salzphasen an Bauwerken röntgenografisch nachgewiesen. Das Austreiben des Hydratwassers bis zum Erhalt von [[Kieserit]] kann bei erhöhten Temperaturen stattfinden. | |||
== Hydratationsdruck == | |||
Die Möglichkeit der Veränderung des Kristallwassergehaltes von Magnesiumsulfaten an Bauwerken ist erwiesen, und es ist anzunehmen, dass Wechsel im Bereich der Kristallwasserstufen [[Pentahydrit]], [[Hexahydrit]] und Epsomit (in Abhängigkeit von klimatischen Veränderungen) in situ durchlaufen werden. Der Einbau eines Wassermoleküles in das Kristallgitter des [[Hexahydrit]] und der Umbildung zu Epsomit ist mit einer Volumenzunahme von rund 10% verbunden. Der daraus resultierende Hydratationsdruck kann bei einer Temperatur von 0-20°C und einer r.F. von ca. 70% mit Werten zwischen 6,8 –9,7 N/mm<sup>2</sup> angegeben werden. Für die Umwandlung von [[Kieserit]] zu [[Hexahydrit]] ist eine Volumenzunahme von ca. 140% anzugeben [nach <bib id="Stark.etal:1996"/>]. | |||
== Analytischer Nachweis == | |||
Kristallisiertes Magnesiumsulfat, welches an einem Objekt vorliegt, kann in unterschiedlichen Morphologien erscheinen, wobei bestimmte Erscheinungsformen vorzugsweise auftreten. Bei einem im Rahmen der Diplomarbeit von Mainusch <bib id="Mainusch:2001"/> untersuchten Objekt stellte sich die Ausbildung eines Gemisches von Epsomit und [[Hexahydrit]] in situ als lockere Kruste einer opaken, grauweißlichen Substanz dar. In Form “körniger Krusten” ist [[Epsomit]] in der Klosterkirche St. Johann in Müstair belegt, Magnesiumsulfatausblühungen in Form von Salz-Whiskern wurden in der St. Georgskirche in der Steiermark in Österreich nachgewiesen. | |||
=== Mikroskopie === | |||
'''Laboruntersuchung:''' | |||
Behauchen einer überwiegend magnesiumsulfathaltigen Ausblühung bewirkt keine makroskopisch beobachtbaren Veränderungen. Charakteristisch hingegen ist das gute Lösungsverhalten in Wasser, ein pH-Wert um 7 und die Ausbildung eines mit bloßem Auge erkennbaren, ringförmigen und leicht erhabenen Saumes bzw. einer transparenten Schicht, die nach dem Verdampfen des wässrigen Lösemittels verbleibt. | |||
Im Labor sind die Ergebnisse der Objekttests unter Zuhilfenahme des Mikroskops zu überprüfen. Die Betrachtung einerseits des Rohprobematerials, wie auch des rekristallisierten Salzes zeigt: Magnesiumsulfatkristalle treten im Probematerial in sehr unspezifischen Erscheinungsformen auf. Versuche, gut ausgebildete Magnesiumsulfat-Einzelkristalle auf dem Wege der Rekristallisation aus wässriger Lösung zu erstellen, erweisen sich als sehr schwierig, da eine starke Verwachsungstendenz besteht. So bildet sich in der Regel der erwähnte auffällige, ringförmige Saum von flach ineinander verwachsenen Kristallen, wenn eine überwiegend magnesiumsulfathaltige Lösung vorsichtig eingedampft wird. Epsomit zeigt eine geringe Löslichkeit in wasserfreiem Ethanol und in Glyzerin, was unter dem Mikroskop gut zu beobachten ist. | |||
Die Tendenz von Magnesiumsulfat, beim Rekristallisieren aus wässriger Lösung kaum äquidimensionale oder elongierte Einzelkristalle auszubilden, erschwert die Erstellung guter Präparate für die weitergehende [[Polarisationsmikroskopie|polarisationsmikroskopische]] Untersuchung beträchtlich. Die geringe Ethanollöslichkeit ermöglicht es allerdings, durch sehr dosierte, eventuell mehrfache Zugabe auf das rekristallisierte Material Einzelpartikel zu isolieren. Sowohl am Ausgangsmaterial, wie auch am rekristallisierten Präparat ist die weiterfolgende Untersuchung am [[polarisationsmikroskopie|Polarisationsmikroskop]] durchzuführen.<br> | |||
'''Brechungsindizes''': n<sub>X</sub> = 1,433, n<sub>y</sub> = 1,455, n<sub>z</sub> <br> | |||
'''Doppelbrechung: '''Δ = max. 0,028 <br> | |||
'''Kristallklasse:''' orthorhombisch | |||
<br> | |||
== Salze und Salzschäden im Bild == | |||
=== Am Objekt === | |||
=== Unter dem Polarisationsmikroskop === | |||
<gallery caption="Auskristallisat aus wässrigen Proben auf Objektträger" widths="200px" heights="150px" perrow="3"> | |||
Image:0141 0010 Bb440um 0021.JPG|Streupräparat einer Salzkruste aus Magnesiumsulfat-Whiskern | |||
Image:CeS 221209-02-10x-01.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-02-10x-02.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-04-2,5kx-01.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-04-2,5kx-02.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-04-2,5kx-03.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:HJS MgSO4 092503-1.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-2.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-3.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-5.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-8.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-9.jpg|Kieseritkristalle | |||
Image:MGSO4 4.5.2006 (11).JPG|Magnesiumsulfat, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MGSO4 4.5.2006 (12).JPG|Magnesiumsulfat, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MGSO4 4.5.2006 (3).JPG|Magnesiumsulfat, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:Magnesiumsulfat pol 01.jpg|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol 400x 01.JPG|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol+analy 400x 01.JPG|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol+analy+rotII 400x 01.JPG|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol+analy.jpg|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
</gallery> | |||
--> | |||
==Weblinks== | |||
<references/> | |||
==Literatur== | |||
<biblist/> | |||
[[Category:Magnesiumsulfat]] [[Category:Stahlbuhk,Amelie]] [[Category:R-MSteiger]] [[Category:Sulfat]] [[Category:Liste]] [[Category:Salz]] | |||
Aktuelle Version vom 3. Mai 2023, 11:16 Uhr
Autoren: Amelie Stahlbuhk
zurück zu Sulfate
| Dieser Artikel wird gerade neu erstellt und ist noch nicht vollständig. |
Absract[Bearbeiten]
Die verschiedenen Hydratformen des Magnesiumsulfats sollen vorgestellt werden, sowie ihr Verhalten bezüglich Löslichkeit und Hygroskopizität.
Hydratformen[Bearbeiten]
Es gibt mehrere Hydratformen des Magnesiumsulfats, wobei wasserfreies Magnesiumsulfat nicht in der Natur vorkommt.
Kieserit MgSO4•H2O
Sanderit MgSO4•2H2O
Starkeyit MgSO4•4H2O
Pentahydrit MgSO4•5H2O
Hexahydrit MgSO4•6H2O
Epsomit MgSO4•7H2O
Meridianiit MgSO4•11H2O
Lösungsverhalten[Bearbeiten]
Die Magnesiumsulfathydratformen gehören zu den leichtlöslichen Salzen (s. Tabelle). Mit der hohen Löslichkeit ist auch eine hohe Mobilität in porösen Materialien verbunden.
| Hydratform | Löslichkeit [mol/kg] bei 20°C |
| Kieserit | 5,60 |
| Starkeyit | 5,04 |
| Pentahydrit | 4,40 |
| Hexahydrit | 3,61 |
| Epsomit | 2,84 |
Das Löslichkeitsdiagramm des MgSO4-H2O-Systems enthält aufgrund der verschiedenen Hydratstufen, mit sowohl stabilen als auch mit metastabilen Gleichgewichten, mehr Inhalte als jene von Salzen mit weniger oder keinen Hydratstufen. Die Temperaturabhängigkeit der Löslichkeit führt dazu, dass mit Temperaturänderungen gegebenenfalls die Hydratation oder die Dehydratation einer betrachteten Phase einhergeht.
Autor / Verfasser: Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M.
 .
.
Hygroskopizität[Bearbeiten]
Je nach Temperatur oder relativer Luftfeuchte kann es bei Änderungen dieser Variablen im System MgSO4-H2O zur Hydratation oder zur Dehydratation beziehungsweise zur Deliqueszenz oder Kristallisation kommen. Bei einer Temperatur von 20 °C ist Epsomit unterhalb seiner Deliqueszenzfeuchte von 91,3 % die vorliegende kristalline Phase. Ab einer relativen Luftfeuchte von etwa 47 % kommt es zur Dehydratation des Salzes zu nierdrigeren Hydratstufen, wie es die Kurven der Gleichgewichtskurven in Abbildung 2 zeigen.
| Betrachtete Phasenübergänge | Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C |
| Epsomit-Lösung | 91,3 % |
| Epsomit-Hexahydrit | 46,6 % |
| Epsomit-Kieserit | 46,7 % |
| Hexahydrit-Starkeyit | 39,1 % |
Autor / Verfasser: Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M.
 .
.
Im Temperaturbereich von -10 bis 100 °C liegen die Deliqueszenzfeuchten der je nach Temperatur vorliegenden Hydratstufen stets oberhalb von 80 % r.F., so dass sie eine geringe Hygroskopizität aufweisen.
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Mainusch:2001] | Mainusch, Nils (2001): Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung, Diplomarbeit, HAWK Hochschule für angewandte Wissenschaft und Kunst Hildesheim/Holzminden/Göttingen, file:Diplomarbeit Nils Mainusch.pdf |   |
| [Stark.etal:1996] | Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
| [Steiger.etal:2011a] | Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M. (2011): Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for Mars. In: Geochimica et Cosmochimica Act, 75 (12), 3600-3626, https://doi.org/10.1016/j.gca.2011.03.038 |  |