Natriumsulfat: Unterschied zwischen den Versionen
(Weiterleitung nach Thenardit erstellt) |
Keine Bearbeitungszusammenfassung |
||
| Zeile 1: | Zeile 1: | ||
# | Autoren: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz ]], [[Benutzer:MSteiger|Michael Steiger]], [[Benutzer:TMueller|Tim Müller]] [[Benutzer:AStahlbuhk|Amelie Stahlbuhk]] | ||
<br> | |||
zurück zu [[Sulfate]] | |||
{{Baustelle}} | |||
==Abstract== | |||
Die verschiedenen Phasen des Natriumsulfats sollen vorgestellt werden, sowie das Verhalten beispielsweise bezüglich Löslichkeit und Hygroskopizität. | |||
==Phasen und Hydratformen== | |||
Bei den vier Phasen des Natriumsulfats sind lediglich zwei stabil. Die weiteren beiden Phasen sind metastabil, wurden aber ebenfalls beobachtet. <br> | |||
[[Thenardit]] Na<sub>2</sub>SO<sub>4</sub> <br> | |||
[[Natriumsulfat Phase III]] Na<sub>2</sub>SO<sub>4</sub> metastabil<br> | |||
[[Natriumsulfat-Heptahydrat]] Na<sub>2</sub>SO<sub>4</sub>•7H<sub>2</sub>O metastabil <br> | |||
[[Mirabilit]] Na<sub>2</sub>SO<sub>4</sub>•10H<sub>2</sub>O | |||
<!-- | |||
==Vorkommen== | |||
Sowohl Thenardit wie auch [[Mirabilit]] erscheinen als natürliche Mineralien. In Mineralwässern, als Ablagerungen ehemaliger Salzseen und in Form unterschiedlicher Doppelsalze tritt Natriumsulfat in der Natur auf. Die Kenntnis des kristallwasserhaltigen Natriumsulfates reicht nachweislich bis in das 16. Jh. zurück. Erste Beschreibungen desselben sind von Glauber aus dem Jahre 1658 überliefert, welcher es als “sal mirable” bezeichnete. Auf dessen Namen zurückgehend ist auch die Trivialbezeichnung “Glaubersalz” für [[Mirabilit]] in der Literatur anzutreffen. | |||
==Angaben zu Herkunft und Bildung von Thenardit und Mirabilit an Baudenkmalen== | |||
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumsulfat als Ausblühsalz entstehen, wenn mit schwefeligen Gasen kontaminierte Luft einwirkt oder sonstige Sulfatquellen vorliegen. Einen hohen Gehalt an Natriumionen weisen Zemente auf, in denen nach DIN-Vorgaben bis zu 0,5% lösliche Alkalien enthalten sein dürfen. Rein rechnerisch können 100 kg Portlandzement mit einem Gehalt von lediglich 0,1% löslichem Na<sub>2</sub>O in schwefelsäurehaltiger Luft 520g [[Mirabilit]] ausbilden [Angaben nach Arnold/Zehnder 1991]. Eine Fülle von Reinigungsmaterialien und v.a. früher verwendeten Restaurierungsprodukten (wie Wasserglas) können Natriumionen in Baudenkmäler eintragen. Als weitere Quellen sind Grundwasser und Oberflächenwasser anzuführen, die Na<sup>+</sup>-Ionen enthalten können. Streusalz besteht zu großem Teil aus leicht löslichem [[Halit|Natriumchlorid]]. In Küstennähe ist [[Halit|NaCl]]-haltiges Meerwasser als Natriumquelle zu berücksichtigen. | |||
--> | |||
==Löslichkeit== | |||
<br clear="all"> | |||
[[File:L Na2SO4.jpg|thumb|800px|right|'''Abbildung 1:''' Löslichkeiten im System Na<sub>2</sub>SO<sub>4</sub>-H<sub>2</sub>O in Abhängigkeit der Temperatur. Aufgetragen ist die Molalität ''m'' [n(Na<sub>2</sub>SO<sub>4</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur, wobei die Gleichgewichte der verschiedenen Phasen durch unterschiedliche Farben der Kurven gekennzeichnet sind. Gestrichelte Kurven markieren metastabile Gleichgewichte. Nach <bib id="Steiger.etal:2008"/>.]] | |||
<br clear="all"> | |||
Die Phasen des Natriumsulfats gehören zu den leichtlöslichen Salzen und weisen somit eine hohe Mobilität in porösen Materialien auf. Die Löslichkeit der verschiedenen Phasen ist stark temperaturabhängig, wie es auch aus der Abbildung 1 hervorgeht. Darüber hinaus ist ersichtlich, dass [[Mirabilit]] nur bis zu einer Temperatur von 32,4 °C stabil ist. Bei höheren Temperaturen ist [[Thenardit]] die stabile kristalline Phase. Unterhalb dieser Umwandlungstemperatur ist widerum Thenardit metastabil. Bei einem Temperaturabfall einer in Bezug auf Thenardit gesättigten Lösung kann es zu hohen Übersättigungen der Lösung bezüglch Mirabilit kommen und somit zur Kristallisation von Mirabilit, womit ein gewisses Schädigungspotezial einhergeht. | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="30%" align="left" class="wikitable" | |||
|+''Tabelle 1: Löslichkeiten in mol/kg verschiedener Natriumsulfat-Phasen bei 20°C [nach <bib id="Steiger.etal:2008"/>].'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| '''Phase''' | |||
|bgcolor = "#F0F0F0" align=center| '''Löslichkeit [mol/kg] bei 20°C''' | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Thenardit]] | |||
|bgcolor = "#FFFFEO" align=center| 3,706 | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Natriumsulfat Phase III]] | |||
|bgcolor = "#FFFFEO" align=center| 4,428 | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Natriumsulfat-Heptahydrat]] | |||
|bgcolor = "#FFFFEO" align=center| 3,143 | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Mirabilit]] | |||
|bgcolor = "#FFFFEO" align=center| 1,353 | |||
|} | |||
<br clear="all"> | |||
==Hygroskopizität== | |||
In Abbildung 2 sind das Deliqueszenzverhalten der Natriumsulfatphasen in Abhängigkeit der Temperatur, sowie die Gleichgewichtsfeuchten der Thenardit-Mirabilit-Umwandlung aufgezeigt. Auch hier ist die Temperaturabhängigkeit zu erkennen. So sinkt die Deliqueszenzfeuchte von Mirabilit mit steigender Temperatur, die von Thenardit steigt hingegen, wenn auch nur geringfügig, mit ansteigender Temperatur. | |||
<br clear="all"> | |||
[[File:D Na2SO4 d.jpg|thumb|800px|right|'''Abbildung 2:''' Deliqueszenzverhalten des Systems Na<sub>2</sub>SO<sub>4</sub>-H<sub>2</sub>O in Abhängingkeit der Temperatur. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur. Deliqueszenzfeuchten der verschiedenen Phasen sind durch unterschiedliche Farben gekennzeichnet. Gestrichelte Kurven markieren metastabile Gleichgewichte. Die Gelichgewichtsfeuchten der Umwandlung Tehnardit/Mirabilit sind ebenfalls abgebildet. Nach <bib id="Steiger.etal:2008"/>.]] | |||
<br clear="all"> | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="30%" align="left" class="wikitable" | |||
|+''Tabelle 1: Deliqueszenz- und Gleichgewichtsfeuchten bei 20 °C [nach <bib id="Steiger.etal:2008"/>].'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| '''Betrachtete Phasenübergänge''' | |||
|bgcolor = "#F0F0F0" align=center| '''Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C''' | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Natriumsulfat Phase III]]-Lösung | |||
|bgcolor = "#FFFFEO" align=center| 82,9 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Thenardit]]-Lösung | |||
|bgcolor = "#FFFFEO" align=center| 86,4 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Natriumsulfat-Heptahydrat]]-Lösung | |||
|bgcolor = "#FFFFEO" align=center| 89,1 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Mirabilit]]-Lösung | |||
|bgcolor = "#FFFFEO" align=center| 95,6 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Thenardit]]-[[Mirabilit]] | |||
|bgcolor = "#FFFFEO" align=center| 76,4 % | |||
|} | |||
<br clear="all"> | |||
<!-- | |||
== Hydratationsverhalten == | |||
<br clear="all"> | |||
[[Datei:Mirabilit Thenardit.ogg|thumb|400px|right|Umwandlung von Mirabilit(?) in Thenardit]] | |||
<br clear="all"> | |||
Das System Na<sub>2</sub>SO<sub>4</sub>–H<sub>2</sub>O: | |||
Als nachweisbare, stabile Hydratstufen existieren lediglich das Anhydrit (Thenardit) und das Decahydrat ([[Mirabilit]]). Die Erzeugung von Mirabilit kann durch Rekristallisation des Salzes aus übersättigter, wäßriger Lösung bei einer Temperatur von unter 32,4°C erfolgen. Insbesondere aufgrund der Hydratstufenbildung, die mit einem Einbau von 10 Wassermolekülen in das Kristallgitter und einer Volumenexpansion von rund 320% verbunden ist und einer niedrigen Übergangstemperatur von ca. 32-35°C, zählen Natriumsulfate zu den sehr verwitterungsaktiven Schadsalzen. Auch dieser Wert ist als Richtwert zu verstehen. Der Phasenübergang [[Mirabilit]] – [[Thenardit]] kann bei einer Temperatur von 25 °C bei einer relativen Feuchte von 80,7 % stattfinden, beträgt die Umgebungstemperatur 0°C, so ist ein Übergang bereits bei einer r.F. von 60,6% möglich [<bib id="Steiger.etal:2008"/>]. Es zeigt sich also auch hier ein starker Temperatureinfluß. Eine Abschätzung der Schadensaktivität durch Kristallisations- und Hydratationsprozesse der Natriumsulfate wird sich an einem Bauwerk bei varierenden Einflußgrößen also sehr schwierig darstellen, da die Klimaparameter das Verhalten extrem beeinflussen. | |||
--> | |||
<!-- | |||
== Hydratationsdruck == | |||
Der Hydratationsdruck, der beim Übergang von Thenardit zu [[Mirabilit]] aufgebaut wird, ist stark abhängig von den bestehenden Luftfeuchte- und Temperaturverhältnissen, was in der nachstehenden Tabelle verdeutlicht ist: | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 3''': Hydratationsdruck Thenardit-[[Mirabilit]] nach <bib id="Winkler.etal:1970"/>'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| '''rel. Feuchte %''' | |||
|bgcolor = "#F0F0F0" align=center| '''20,0 °C''' | |||
|bgcolor = "#F0F0F0" align=center| '''25,0 °C''' | |||
|bgcolor = "#F0F0F0" align=center| '''30,0 °C''' | |||
|- | |||
|bgcolor = "#F7F7F7" align=center| '''100''' | |||
|bgcolor = "#FFFFEO" align="center"| 48,9 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 40,5 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 28,9 N/mm<sup>2</sup> | |||
|- | |||
|bgcolor = "#F7F7F7" align=center| '''95,0''' | |||
|bgcolor = "#FFFFEO" align="center"| 41,3 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 32,7 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 23,3 N/mm<sup>2</sup> | |||
|- | |||
|bgcolor = "#F7F7F7" align="center"| '''90,0''' | |||
|bgcolor = "#FFFFEO" align="center"| 33,5 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 24,9 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 13,7 N/mm<sup>2</sup> | |||
|- | |||
|bgcolor = "#F7F7F7" align="center"| '''85,0''' | |||
|bgcolor = "#FFFFEO" align="center"| 25,5 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 16,0 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 5,1 N/mm<sup>2</sup> | |||
|- | |||
|bgcolor = "#F7F7F7" align="center"| '''80,0''' | |||
|bgcolor = "#FFFFEO" align="center"| 16,4 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 7,8 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 0,0 | |||
|- | |||
|bgcolor = "#F7F7F7" align="center"| '''75,0''' | |||
|bgcolor = "#FFFFEO" align="center"| 6,7 N/mm<sup>2</sup> | |||
|bgcolor = "#FFFFEO" align="center"| 0,0 | |||
|bgcolor = "#FFFFEO" align="center"| - | |||
|} | |||
<br clear=all> | |||
Die Volumenveränderung, die beim Phasenübergang stattfindet, ist mit ca. 320% anzugeben <bib id="Sperling.etal:1980"/>. | |||
--> | |||
<!-- | |||
== Analytischer Nachweis == | |||
=== Mikroskopie<br> === | |||
'''Laboruntersuchung:'''<br>Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu verifizieren. Thenardit und [[Mirabilit]] besitzen keine morphologische Charakterisitka, die bei einfachen Rekristallisationsversuchen zur Identifizierung beitragen können. Vielmehr ist eine große Bandbreite unterschiedlichster Erscheinungsformen beobachtbar.<br> | |||
'''Brechungsindizes:''' n<sub>x</sub> = 1,468; n<sub>y</sub> =1,473; n<sub>z</sub> =1,483<br>'''Doppelbrechung''': Δ = 0.015<br>'''Kristallklass'''e: orthorhombisch<br> | |||
<br> | |||
'''[[Polarisationsmikroskopie|Polarisationsmikroskopische]] Untersuchung:'''<br> | |||
In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Rohprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockner Luft (mit r.F. < 80% und Raumtemperatur) verliert [[Mirabilit]] sein Kristallwasser und geht in Thenardit über. Dieser Vorgang kann mikroskopisch klar nachvollzogen werden, wenn der Prozess der Rekristallisation beobachtet wird. [[Mirabilit]] weist charakteristische anormale Interferenzfarbe auf, im Zuge des Wasserverlustes und Entstehen von Thenardit schwächen sich die anormalen Interferenzphänomene zunehmend ab.<br><br>Die Zuweisung der Brechungsindizes von Thenardit erfolgt entsprechend der Immersionsmethode. Aufgrund der niedrigen maximalen Doppelbrechung zeigt Thenardit zumeist graue Interferenzfarben. Die Auslöschung ist parallel oder symmetrisch. | |||
<br>'''Verwechslungsmöglichkeiten:''' | |||
Generell ist die Unterscheidung einer bestimmten Anzahl von Sulfaten (die unten aufgelistet sind und wozu Thenardit zählt) ohne mikrochemische Bestimmung der Anionen problematisch, da die Brechungsindizes der Salze dicht beieinander liegen und alle Salze eine niedrige Doppelbrechung aufweisen. Hilfreich ist die Verwendung eines Immersionsmittels mit einem n<sub>D</sub>-Wert von 1,48. Eine Differenzierung innerhalb dieser Gruppe wird damit möglich. Außerdem können die unten genannten Eigenschaften als Abgrenzungskriterien hinzugezogen werden. | |||
Eindeutig bestimmbar wird Thenardit durch die Möglichkeit, nach Auflösung des Probematerials im Zuge der Rekristallisation das Phänomen anormaler Interferezfarben beobachten zu können, sprich [[Mirabilit]] in der hohen Hydratstufe zu identifizieren und somit indirekt Thenardit nachzuweisen. | |||
{|border="2" cellspacing="0" cellpadding="4" width="100%" align="left" class="wikitable" | |||
|+''Tabelle 3''': Unterscheidungsmerkmale zu anderen Sulfaten'' | |||
|- | |||
|bgcolor = "#F0F0F0"| '''Salzphase''' | |||
|bgcolor = "#F0F0F0"| '''Unterscheidungsmerkmal''' | |||
|- | |||
|bgcolor = "#F7F7F7"| '''[[Boussingaultit]]''' (NH<sub>4</sub>)<sub>2</sub>Mg(SO)<sub>4</sub> • 6H<sub>2</sub>0 | |||
|bgcolor = "#FFFFEO"| keine anormalen Interferenzfarben / schiefe Auslöschung | |||
|- | |||
|bgcolor = "#F7F7F7"| '''[[Schönit|Pikromerit]]''' K<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | |||
|bgcolor = "#FFFFEO"| keine anormalen Interferenzfarben / schiefe Auslöschung | |||
|- | |||
|bgcolor = "#F7F7F7"|'''[[Astrakanit|Bloedit]]''' Na<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | |||
|bgcolor = "#FFFFEO"| alle Indizes >1,48 / keine anormalen Interferenzfarben / schiefe Auslöschung / optisch negativ orientiert. | |||
|- | |||
|bgcolor = "#F7F7F7"| '''[[Aphthitalit|Glaserit]]''' K<sub>3</sub>Na(SO<sub>4</sub>)<sub>2</sub> | |||
|bgcolor = "#FFFFEO"| alle Indizes >1,48 / keine anormalen Interferenzfarben/schiefe Auslöschung | |||
|- | |||
|bgcolor = "#F7F7F7"| '''[[Arcanit]]''' K<sub>2</sub>SO<sub>4</sub> | |||
|bgcolor = "#FFFFEO"| alle Indizes >1,48 / keine anormalen Interferenzfarben | |||
|- | |||
|bgcolor = "#F7F7F7"| '''[[Magnesiumformiat]]''' Mg(HCO<sub>2</sub>)<sub>2</sub> • 2H<sub>2</sub>O | |||
|bgcolor = "#FFFFEO"| vergleichsweise hohe Doppelbrechung / keine anormalen Interfernzfarben / schiefe Auslöschung | |||
|} | |||
<br> | |||
'''Betrachtung von Mischsystemen:''' | |||
Mischsystem Na<sup>+</sup>– Ca<sup>2+</sup>– SO<sub>4</sub> <sup>2-</sup>: Der Ausfall von [[Gips]] erfolgt im Zuge der Rekristallisation entsprechend der geringeren Löslichkeit desselben zuerst. Der charakteristische nadelige Habitus von einzelnen Gipskristallen wie auch von Aggregaten bleibt bestehen. Der Ausfall von Natriumsulfat erfolgt später, das eigentliche Kristallwachstum vollzieht sich merklich schneller. Die Morphologie ist unspezifisch. | |||
Mischsystem Na<sup>+</sup>– SO<sub>4</sub> <sup>2-</sup>– Cl<sup>-</sup>: Der Ausfall der beiden Partikelsorten beginnt etwa zeitgleich. Halit mit charakteristischer Morphologie, Natriumsulfat in extrem variierender Gestalt. | |||
=== Röntgendiffraktometrie === | |||
=== Raman-Stektroskopie === | |||
=== DTA / TG === | |||
=== IR-Spektroskopie === | |||
<br> | |||
<br> | |||
<br> | |||
--> | |||
== Salze und Salzschäden im Bild == | |||
=== Unter dem Polarisationsmikrokop === | |||
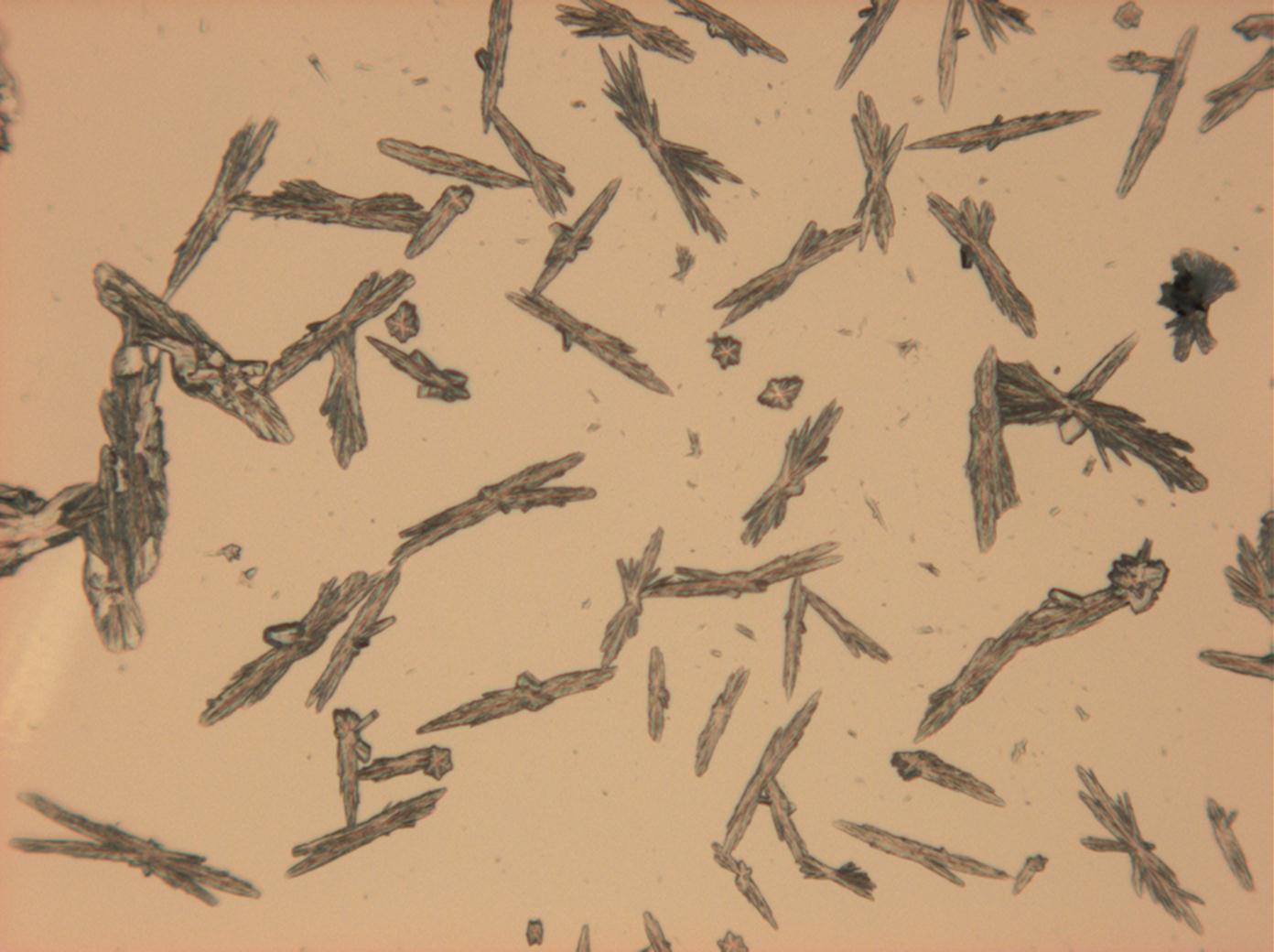
<gallery caption="Natriumsulfat-Kristalle zwischen zwei Objektträgern kristallisiert" widths="200px" heights="150px" perrow="3"> | |||
Image:HJS Na2SO4-slides-6.jpg |in einfach polarisiertem Licht | |||
Image:HJS Na2SO4-slides-1.jpg| mit gekreuzten Polarisatoren und Rot I | |||
Image: | | |||
Image:HJS Na2SO4-slides-110703-10x-3.jpg|in einfach polarisiertem Licht | |||
Image:HJS Na2SO4-slides-110703-10x-2.jpg| mit gekreuzten Polarisatoren | |||
Image:HJS Na2SO4-slides-110703-10x-1.jpg| mit gekreuzten Polarisatoren und Rot I | |||
Image:HJS Na2SO4-slides-2-110603.jpg|in einfach polarisiertem Licht | |||
Image:HJS Na2SO4-slides-1-110603.jpg| mit gekreuzten Polarisatoren und Rot I | |||
Image: | | |||
Image:HJS-Na2SO4-111703-02-10x.jpg|in einfach polarisiertem Licht | |||
Image:HJS-Na2SO4-111703-04-10x.jpg|in einfach polarisiertem Licht | |||
Image:HJS-Na2SO4-111703-01-10x.jpg| mit gekreuzten Polarisatoren und Rot I | |||
</gallery> | |||
<br> | |||
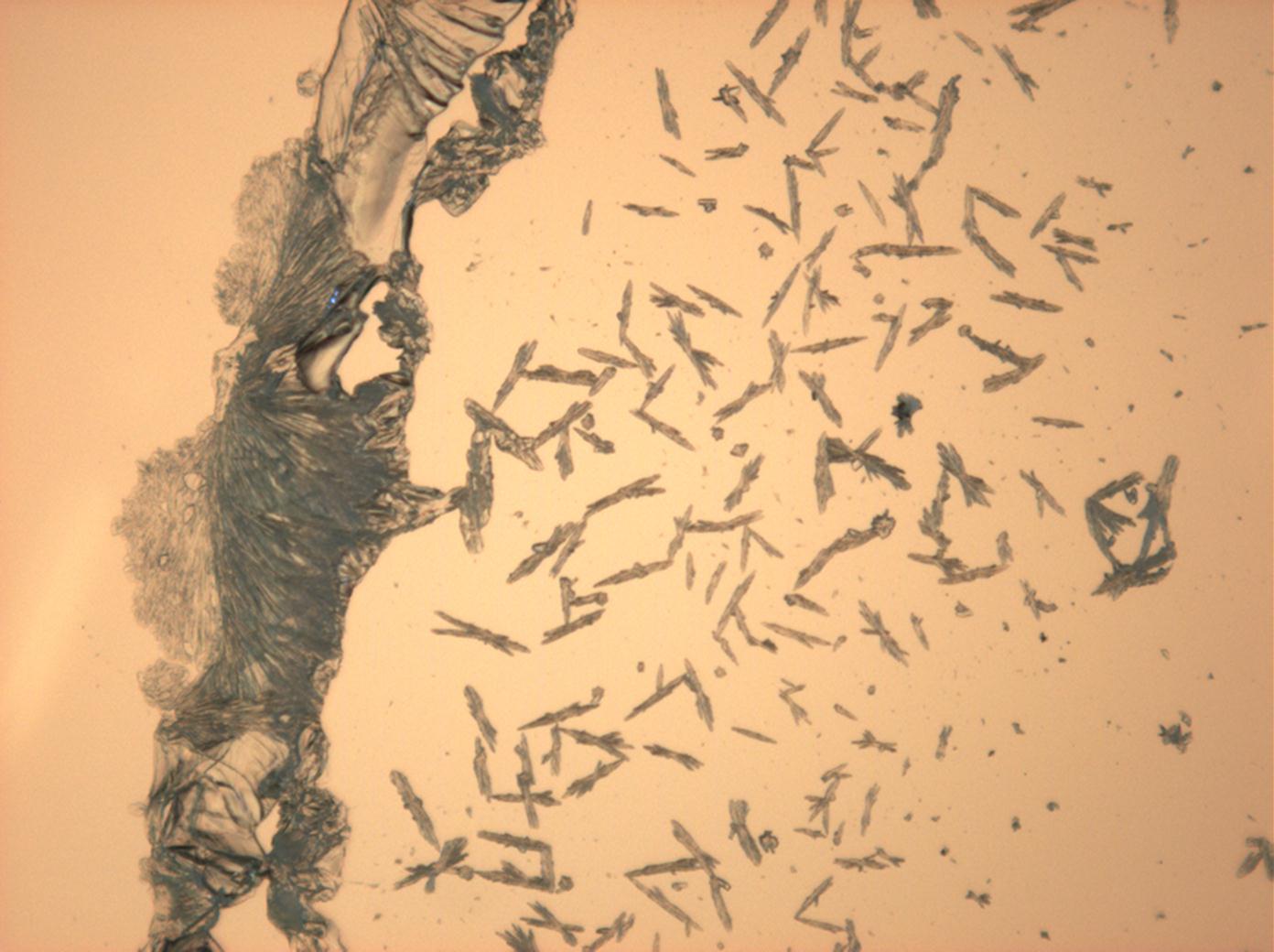
<gallery caption="Natriumsulfat-Kristalle, kristallisiert aus wässriger Lösung von Realproben" widths="200px" heights="150px" perrow="3"> | |||
Image:HJS Na2SO4 092503-3.jpg|in einfach polarisiertem Licht | |||
Image:HJS Na2SO4 092503-4.jpg|in einfach polarisiertem Licht | |||
</gallery> | |||
== Weblinks == | |||
<references /> | |||
== Literatur == | |||
<biblist/> | |||
'''Weitere Literatur''' | |||
<bibprint filter=" title:%Na2SO4%"/> | |||
[[Category:Natriumsulfat]][[Category:Stahlbuhk,Amelie]][[Category:Schwarz,Hans-Jürgen]][[Category:R-MSteiger]][[Category:Review]][[Kategorie:Müller,Tim]][[Category:Sulfat]] [[Category:Salz]][[Category:Liste]] | |||
Version vom 30. März 2015, 14:57 Uhr
Autoren: Hans-Jürgen Schwarz , Michael Steiger, Tim Müller Amelie Stahlbuhk
zurück zu Sulfate
| Dieser Artikel wird gerade neu erstellt und ist noch nicht vollständig. |
Abstract[Bearbeiten]
Die verschiedenen Phasen des Natriumsulfats sollen vorgestellt werden, sowie das Verhalten beispielsweise bezüglich Löslichkeit und Hygroskopizität.
Phasen und Hydratformen[Bearbeiten]
Bei den vier Phasen des Natriumsulfats sind lediglich zwei stabil. Die weiteren beiden Phasen sind metastabil, wurden aber ebenfalls beobachtet.
Thenardit Na2SO4
Natriumsulfat Phase III Na2SO4 metastabil
Natriumsulfat-Heptahydrat Na2SO4•7H2O metastabil
Mirabilit Na2SO4•10H2O
Löslichkeit[Bearbeiten]
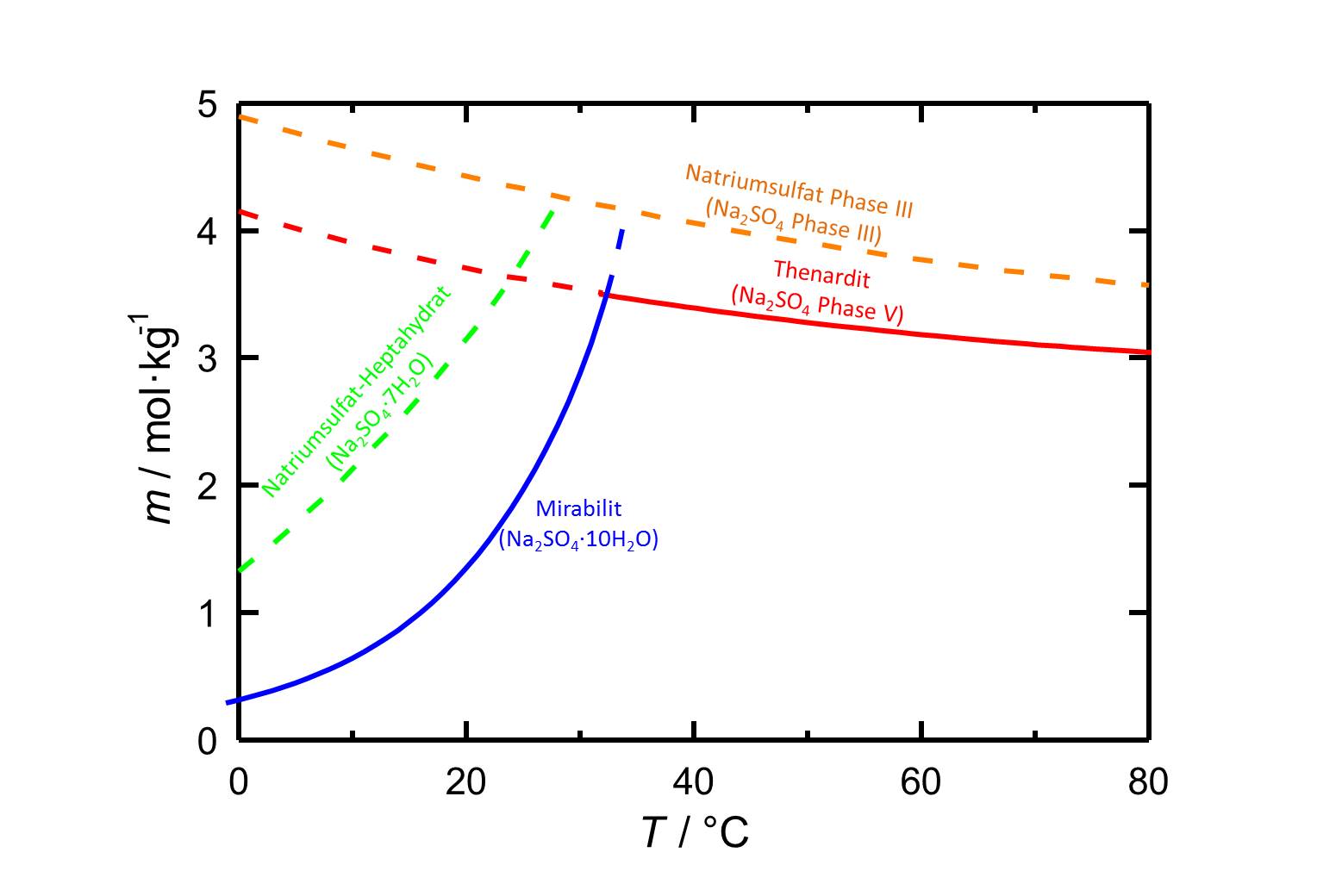
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke
 .
.
Die Phasen des Natriumsulfats gehören zu den leichtlöslichen Salzen und weisen somit eine hohe Mobilität in porösen Materialien auf. Die Löslichkeit der verschiedenen Phasen ist stark temperaturabhängig, wie es auch aus der Abbildung 1 hervorgeht. Darüber hinaus ist ersichtlich, dass Mirabilit nur bis zu einer Temperatur von 32,4 °C stabil ist. Bei höheren Temperaturen ist Thenardit die stabile kristalline Phase. Unterhalb dieser Umwandlungstemperatur ist widerum Thenardit metastabil. Bei einem Temperaturabfall einer in Bezug auf Thenardit gesättigten Lösung kann es zu hohen Übersättigungen der Lösung bezüglch Mirabilit kommen und somit zur Kristallisation von Mirabilit, womit ein gewisses Schädigungspotezial einhergeht.
| Phase | Löslichkeit [mol/kg] bei 20°C |
| Thenardit | 3,706 |
| Natriumsulfat Phase III | 4,428 |
| Natriumsulfat-Heptahydrat | 3,143 |
| Mirabilit | 1,353 |
Hygroskopizität[Bearbeiten]
In Abbildung 2 sind das Deliqueszenzverhalten der Natriumsulfatphasen in Abhängigkeit der Temperatur, sowie die Gleichgewichtsfeuchten der Thenardit-Mirabilit-Umwandlung aufgezeigt. Auch hier ist die Temperaturabhängigkeit zu erkennen. So sinkt die Deliqueszenzfeuchte von Mirabilit mit steigender Temperatur, die von Thenardit steigt hingegen, wenn auch nur geringfügig, mit ansteigender Temperatur.
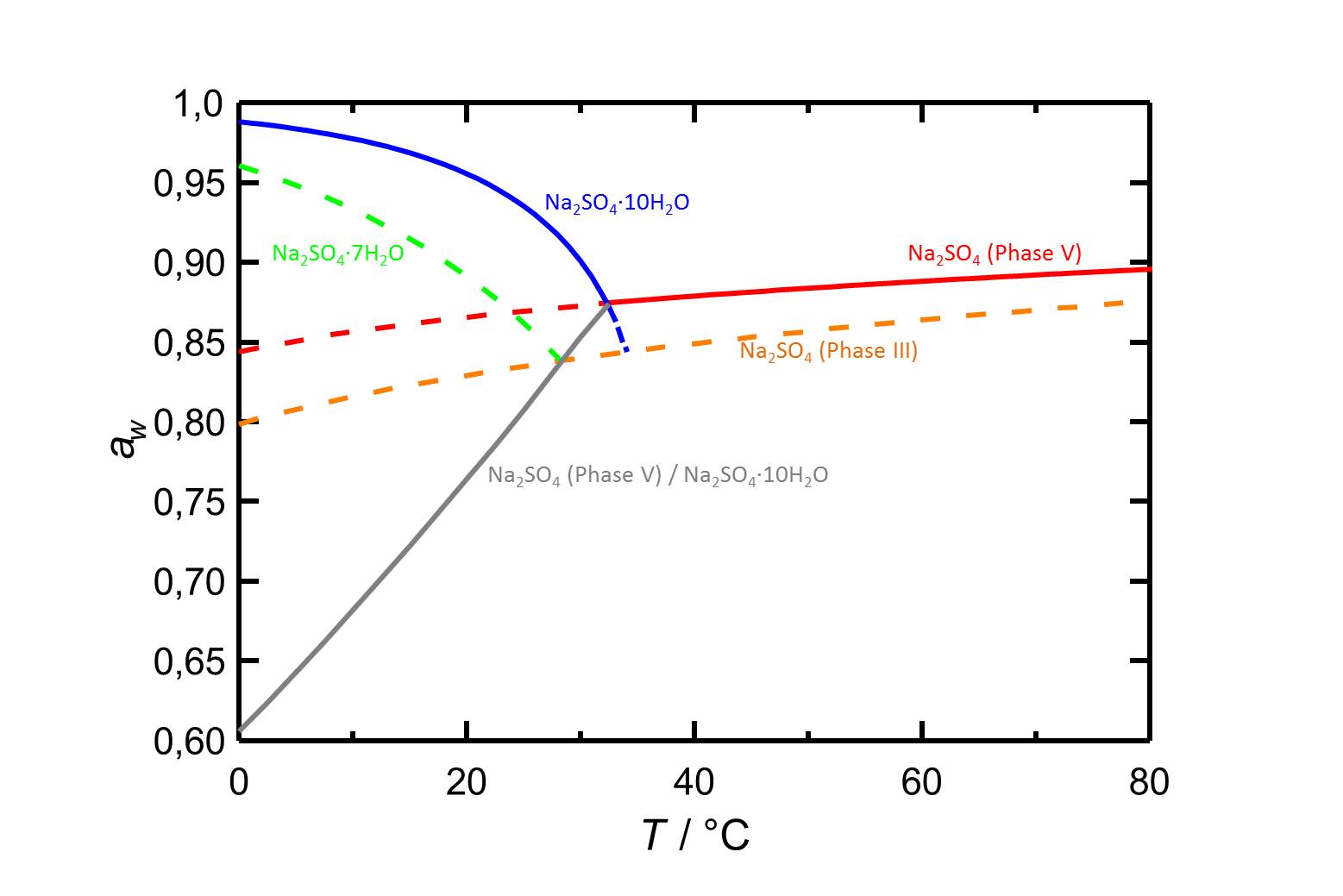
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke
 .
.
| Betrachtete Phasenübergänge | Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C |
| Natriumsulfat Phase III-Lösung | 82,9 % |
| Thenardit-Lösung | 86,4 % |
| Natriumsulfat-Heptahydrat-Lösung | 89,1 % |
| Mirabilit-Lösung | 95,6 % |
| Thenardit-Mirabilit | 76,4 % |
Salze und Salzschäden im Bild[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Natriumsulfat-Kristalle zwischen zwei Objektträgern kristallisiert
- Natriumsulfat-Kristalle, kristallisiert aus wässriger Lösung von Realproben
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Sperling.etal:1980] | Sperling, C.H.B.and Cooke, R.U. (1980): Salt Weathering on Arid Environment, I. Theoretical ConsiderationsII. Laboratory Studies. In: Papers in Geography, 8 () |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Winkler.etal:1970] | Winkler, Erhard M.; Wilhelm, E.J. (1970): Saltburst by Hydration Pressure in Architectural Stone in Urban Atmosphere. In: Geological Society of America, Bulletin, 81 (), 567-572 |  |
Weitere Literatur
| [Amirthalingam.etal:1977] | Amirthalingam V., Karkhanavala M. D., Rao U. R. K. (1977): Topotaxic phase change in Na2SO4. In: Acta Crystallographica Section A, 33 (3), 522-523, https://doi.org/10.1107/S0567739477001296 |  |
| [Amirthalingam:1977] | Amirthalingam, V.; Karkhanaavala, M. D.; Rao, U. R. K. (1977): Topotaxic phase change in Na2SO4. In: Acta Cryst., A33 (), 522-523 |  |
| [Bayh.etal:1966] | Bayh, W.; Haussuehl, Siegfried (1966): Elastische und mechanische Eigenschaften von Na2SO4 (Thenardit). In: Acta Crystallogr, 20 (6), 931-932 |  |
| [Bednarska.etal:2022] | Bednarska, D.; Koniorczyk, M.; Steiger, M. (2022): Identification of various salt crystallization and water freezing patterns induced by temperature variation from Na2SO4 – H2O system confined in porous materials. In: Construction and Building Materials, 347 (), Webadresse, https://doi.org/10.1016/j.conbuildmat.2022.128540 |  |
| [Brown.etal:2000] | Brown, P. W.; Badger, S. (2000): The distributions of bound sulfates and chlorides in concrete subjected to mixed NaCl, MgSO4, Na2SO4 attack. In: Cem. Concr. Res., 30 (10), 1535-1542 |  |
| [Brown.etal:2001] | Brown, P. W.; Badger, S. (2001): Reply to the discussion by William G. Hime and Stella L. Marusin of the paper "The distribution of bound sulfates and chlorides in concrete to mixed NaCl, MgSO4, Na2SO4 attack". In: Cem. Concr. Res., 31 (7), 1117-1118 |  |
| [CHEN.etal:2024] | Dong-Mei Chen; Kun Yuan; Xian-Ming Zhang (2024): Morphology transformation of Na2SO4 from prism into dendrite enhanced desalination efficiency in sandstone by biodegradable polycarboxylate modifiers. In: Construction and Building Materials, 411 (), 134513, Webadresse, https://doi.org/10.1016/j.conbuildmat.2023.134513 |  |
| [DeClercq.etal:2012] | Clercq, Hilde; Jovanović, Maja; Linnow, Kirsten; Steiger, Michael (2012): Performance of limestones laden with mixed salt solutions of Na2SO4–NaNO3 and Na2SO4–K2SO4. In: Environmental Earth Sciences, (), 1-11, Webadresse, 10.1007/s12665-012-2017-0 |  |
| [Donkers.etal:2015] | Donkers, P.; Linnow, K.; Pel, L.; Steiger, M.; Adan,O. (2015): Na2SO4·10H2O dehydration in view of thermal storage. In: Chemical Engineering Science, 134 (), 360-366, Webadresse, https://doi.org/10.1016/j.ces.2015.05.028 |  |
| [Freyer.etal:1997] | Freyer, D.; Fischer, St.; Koehnke, K.and Voigt W. (1997): Formation of double salt hydrates: I Hydration of quenched Na2SO4-CaSO4 phases. In: Solid State Ionics, 96 (2), 29-33, 10.1016/S0167-2738(96)00612-1, |  |
| [Friedel:1978] | Friedel, B. (1978): Gipslöslichkeiten in wässerigen Systemen mit NaCl, MgCl2, Na2SO4 und MgSO4. In: Zeitschrift für Pflanzenernährung und Bodenkunde, 141 (3), 337-346, 10.1002/jpln.19781410309 |  |
| [Granneman.etal:2019] | Granneman, S.J.C.; Lubelli, B.; van Hees, R.P.J. (2019): Effect of mixed in crystallization modifiers on the resistance of lime mortar against NaCl and Na2SO4 crystallization. In: Construction and Building Materials , 194 (), 62-70, Webadresse |  |
| [Lindstroem.etal:2014] | Lindström, N.; Talreja, T.; Linnow, K.; Steiger, M. (2014): Crystallization behavior of a Na2SO4–MgSO4 salt mixture and comparison to single salt behavior. In: Hilde De Clercq (Hrsg.): Proceedings of SWBSS 2014 3rd International Conference on Salt Weathering of Buildings and Stone Sculptures,KIK-IRPA, Royal Institute for Cultural Heritage Brussels 151-165, 10.5165/hawk-hhg/258. |   |
| [Lindstroem.etal:2015] | Nadine Lindström; Nicole Heitmann; Kirsten Linnow; Michael Steiger (2015): Crystallization behavior of NaNO3–Na2SO4 salt mixtures in sandstone and comparison to single salt behavior. In: Applied Geochemistry, 63 (), 116 - 132, Webadresse, https://doi.org/10.1016/j.apgeochem.2015.07.007 |  |
| [Lindstroen.etal:2016] | Nadine Lindström; Tanya Talreja; Kirsten Linnow; Amelie Stahlbuhk; Michael Steiger (2016): Crystallization behavior of Na2SO4–MgSO4 salt mixtures in sandstone and comparison to single salt behavior. In: Applied Geochemistry, 69 (), 50 - 70, Webadresse, https://doi.org/10.1016/j.apgeochem.2016.04.005 |  |
| [Linnow.etal:2012] | Linnow, Kirsten; Steiger, Michael; Lemster, Christine; Clercq, Hilde; Jovanović, Maja (2012): In situ Raman observation of the crystallization in NaNO3–Na2SO4–H2O solution droplets. In: Environmental Earth Sciences, (), 1-12, Webadresse, 10.1007/s12665-012-1997-0 |  |
| [Marliacy.etal:2000] | Marliacy, P.; Solimando, R.; Bouroukba, M.; Schuffenecker, L. (2000): Thermodynamics of crystallization of sodium sulfate decahydrate in H2O-NaCl-Na2SO4: application to Na2SO4.cntdot.10H2O-based latent heat storage materials. In: Thermochim. Acta, 344 (1), 85-94 |  |
| [Moffadel.etal:1991] | Moffadel, N.; Bouzaziz, R.; Mayer, M. (1991): Le polymorphisme du sulfate de sodum anhydre et les phases intermédiaries, glasérite et aphtitalite, dans le binaire Na2SO4-K2SO4. In: Thermochimica Acta, 185 (1), 141-153, 10.1016/0040-6031(91)80125-3 |  |
| [Naruse.etal:1987] | Naruse, H.; Tanaka, K.; Morikawa, H.; Marumo, F. (1987): Structure of Na2SO4(I) at 693 K. In: Acta Crystallographica, B43 (), 143-146 |  |
| [Nord:1973] | Nord, Anders G. (1973): Refinement of the Crystal Structure of Thenardite, Na2SO4(V). In: Acta Chem. Scand., 27 (3), 814-822 |  |
| [Platford:1975] | Platford, R. F. (1975): Thermodynamics of the system H2O-NaCl-MgCl2-Na2SO4-MgSO4 at 25 degrees C. In: Mar. Chem., 3 (4), 261-270 |  |
| [Potter.etal:1978] | Potter, R. W. I.; Clynne, M. A. (1978): Solubility of high soluble salts in aqueous media; Part 1, NaCl, KCl, CaCl2, Na2SO4, and K2SO4 solubilities to 100 degrees C. In: Journal of Research of the U. S. Geological Survey, 6 (6), 701-705 |  |
| [Ptacek.etal:1992] | Ptacek, C. J.; Reardon, E. J. (1992): Solubility of siderite (FeCO3) in concentrated NaCl and Na2SO4 solutions at 25 degrees C. In: Kharaka, Yousif K.; Maest, Ann S. (Hrsg.): Proceedings of the 7th international symposium on water-rock interaction, 181-184. |  |
| [Rard:1979] | Rard, J. A.; Miller, D. G. (1979): The mutual diffusion coefficients of Na2SO4-H2O and MgSO4-H2O at 25 degrees C from Rayleigh interferometry. In: J. Solut. Chem., 8 (10), 755-756 |  |
| [Rasmussen.etal:1996] | Rasmussen, Svend Erik; Jorgensen, Jens-Erik; Lundoft, Britta (1996): Structure and phase transition of Na2SO4. In: Journal of Applied Crystallography, 29 (), 42-47, 10.1107/S0021889895008818 |  |
| [Sarada.etal:1990] | Sarada, S.; Ananthaswamy, J. (1990): Thermodynamic Properties of Electrolyte Solutions: Emf Study of the System NaCl-Na2SO4-H20 at 25, 35 and 45 ÄC. In: Journal Chem. Soc. Faraday Trans., 86 (1), 81-84 |  |
| [Shen.etal:2020] | Shen, Y.; Linnow, K.; Steiger, M. (2020): Crystallization Behavior and Damage Potential of Na2SO4-NaCl Mixtures in Porous Building Materials. In: Crystal Growth & Design, 20 (9), 5974-5985, https://doi.org/10.1021/acs.cgd.0c00671 |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Tishchenko.etal:1992] | Tishchenko, Pavel Ya.; Bychkov, Alexander S.; Hravéczy-Páll, Andrea; Tóth, Klára; Pungor, Ernoe (1992): Activity Coefficients for the System NaCl + Na2SO4 + H2O at Various Temperatures. Application of Pitzer's Equations. In: Journal of Solution Chemistry, 21 (3), 261-274 |  |
| [Xu.etal:1999] | Xu B., Schweiger G. (1999): In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.. In: J. Aerosol. Sci., (), 379-380, Webadresse, https://doi.org/10.1016/S0021-8502(99)80201-8 |  |
| [Zdanovskii.etal:1991] | Zdanovskii, A. B.; Frolovskii, E. E. (1991): Equations for calculating the solubility of mirabilite in the aqueoussodium chloride-magnesium sulfate (2NaCl + MgSO4 = Na2SO4 + MgCl2) system at 0-25.degree. In: Zh. Prikl. Khim. (Leningrad), 64 (6), 1153-7 |  |