Niter
Autoren: Hans-Jürgen Schwarz, Nils Mainusch
zurück zu Nitrate
| Niter[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Nitrokalit, Niter, Kalisalpeter |
| Chemische Bezeichnung | Kaliumnitrat |
| Trivialname | Salpeter, Kali-Salpeter, Kehrsalpeter, Konversionssalpeter |
| Chemische Formel | KNO3 |
| Hydratformen | keine |
| Kristallsystem | orthorhombisch-test |
| Deliqueszenzfeuchte 20°C | 93,7% |
| Löslichkeit(g/l) bei 20°C | 315 g/l |
| Dichte (g/cm³) | 2,109 g/cm3 |
| Molares Volumen | 48,04 cm3/mol |
| Molare Masse | 101,11 g/mol |
| Transparenz | durchsichtig bis undurchsichtig |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | rhombenförmig |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | in Wasser leicht löslich |
| Bemerkungen | |
| Kristalloptik | |
| Brechungsindices | nx = 1,335 ny = 1,505 nz = 1,506 |
| Doppelbrechung | Δ = 0,171 |
| Optische Orientierung | zweiachsig negativ |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| {{{Literatur}}} | |
Abstract[Bearbeiten]
Niter ist eines der wichtigsten Salze, die an z. B. Bauwerken und Wandmalereien für Schäden verantwortlich sind. Insbesondere in Innenräumen ist er häufig als sichtbare, oft watteartige Ausblühungen zu finden. Abbildungen, Mikroaufnahmen und Beispiele aus der Praxis ergänzen und veranschaulichen das Dargelegte.
Allgemeines[Bearbeiten]
Kalisalze waren bis in das 19. Jh. ein wichtiger Rohstoff für die Herstellung von Schieß- und Sprengstoffen und wurden natürlichen Lagern entnommen (Kalilagerstätten enthalten neben diversen Kalirohsalzen maximal etwa 10% KNO3) oder aber durch Umwandlung von Natriumnitrat mittels Kaliumchlorid gewonnen. Derzeitig existieren unterschiedliche Verfahren großtechnischer Herstellung des Salzes durch die Umsetzung von Kalirohsalzen mit Salpetersäure.
Anwendung findet Kaliumnitrat gegenwärtig in der Landwirtschaft als Düngemittel.
Vorkommen von Niter[Bearbeiten]
In Form einer natürlichen Ablagerung kann Kaliumnitrat überall dort entstehen, wo (beispielsweise im Zuge der Verwesung organischer Materie) Stickstoffverbindungen synthetisiert werden und in ausreichender Menge Kaliumionen vorliegen. Großen Mengen nitrifizierbarer Bestandteile und Stickstoffverbindungen sind bekanntermaßen in Dung und Harn von Lebewesen enthalten.
Angaben zu Herkunft und Bildung von Niter an Baudenkmalen[Bearbeiten]
Als wesentliche Eintragsquellen für Kaliumionen kommt belastetes Grundwasser und der Eintrag aus mit NOx -belasteter Luft durch Immission in Betracht. Zudem können Bau- und Restaurierungsmaterialien lösliche Kaliumverbindungen enthalten. Erwähnt seien Kaliwasserglas, Kalilauge (als Reinigungsmittel) und Zemente.
Nitrate können aus biogenen Quellen stammen und über kapillaren Feuchtetransport in das Materialgefüge gelangen. Als wichtige mögliche Nitratquelle ist mikrobielle Aktivität durch Nitrifikanten anzuführen.
Lösungsverhalten[Bearbeiten]
Autor / Verfasser: Stark, Jochen; Stürmer, Sylvia
 )
)
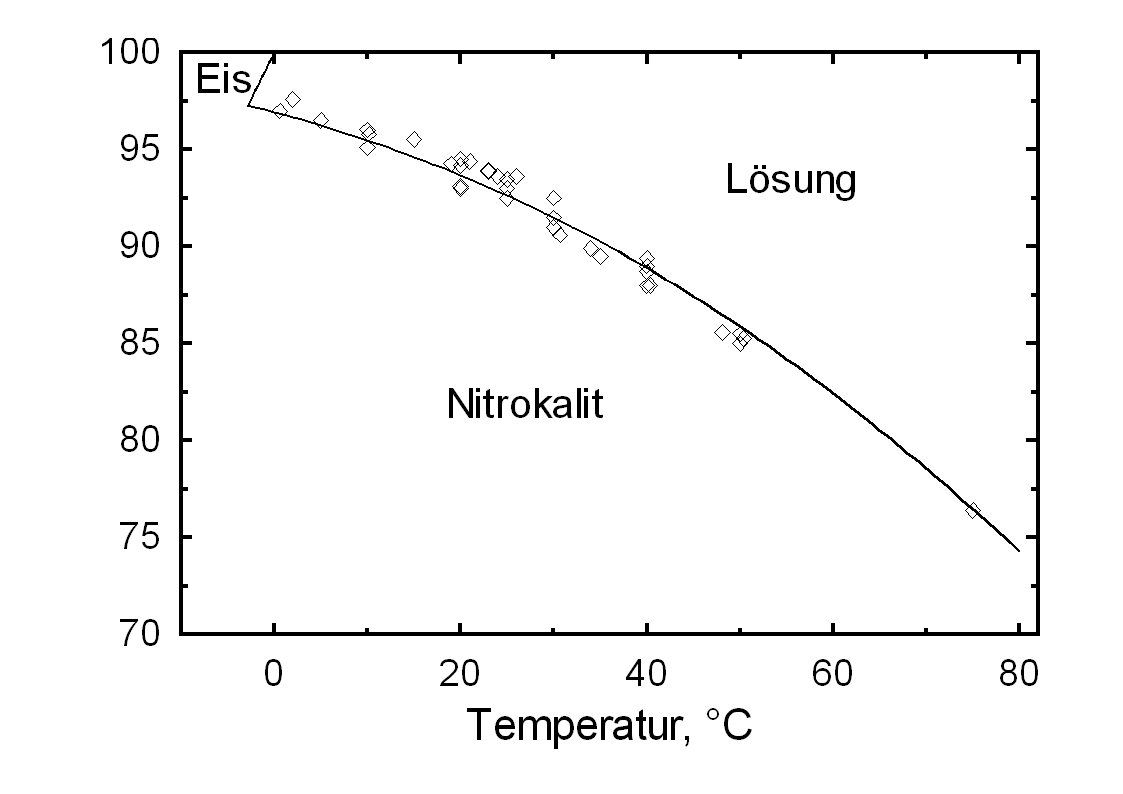
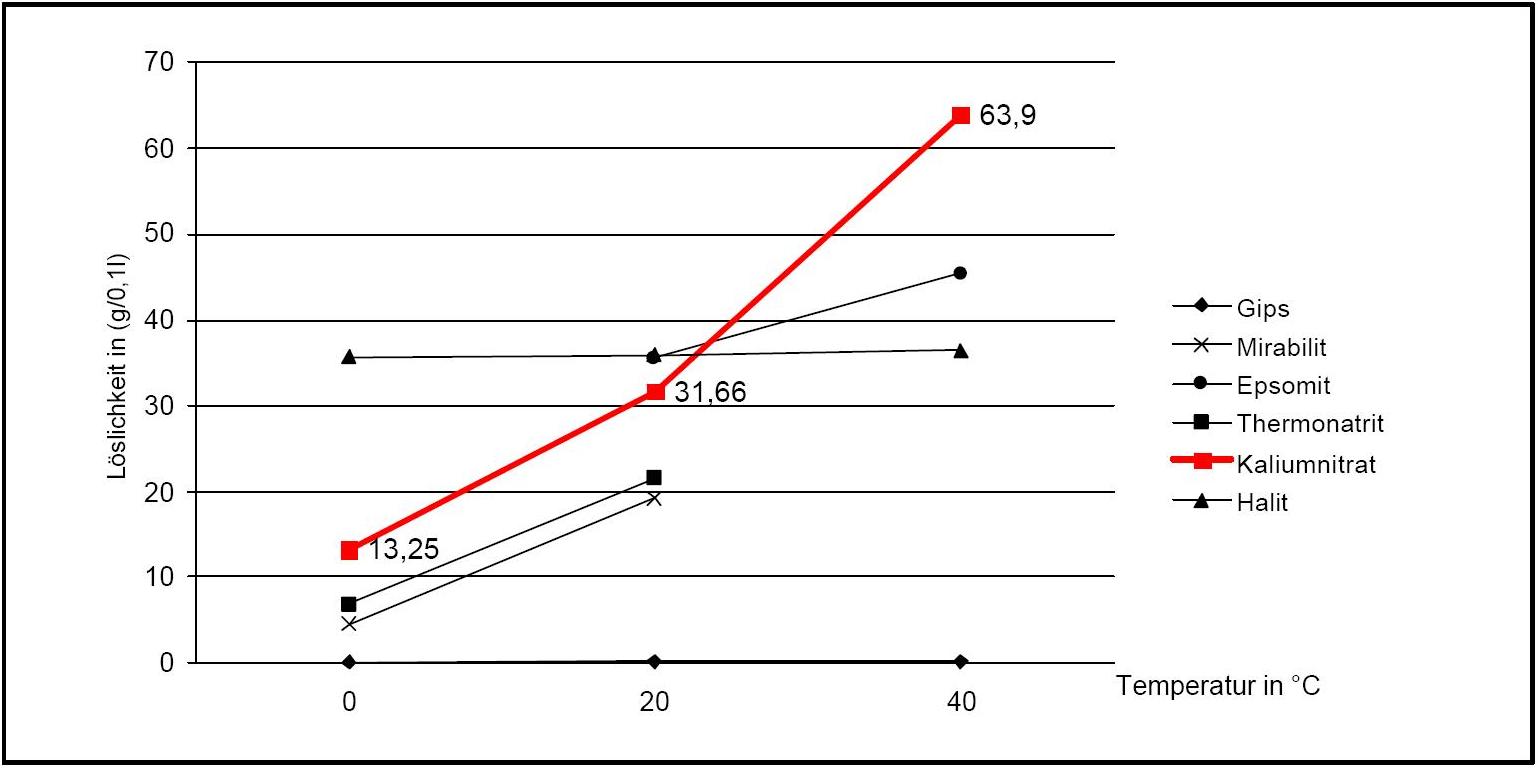
Kaliumnitrat besitzt eine gute Wasserlöslichkeit und zählt somit zur Gruppe der mobilen Salze, was mit häufigen Veränderungen der Anreicherungszonen am Objekt verbunden sein kann. Der Temperatureinfluss auf die Wasserlöslichkeit ist hoch, was am steilen Kurvenverlauf in Diagramm 1 abzulesen ist.
Verbunden ist hiermit die Gefahr einer Lösungsübersättigung bei raschem Temperaturabfall und einer Kristallisation des Salzes.
Hygroskopizität[Bearbeiten]
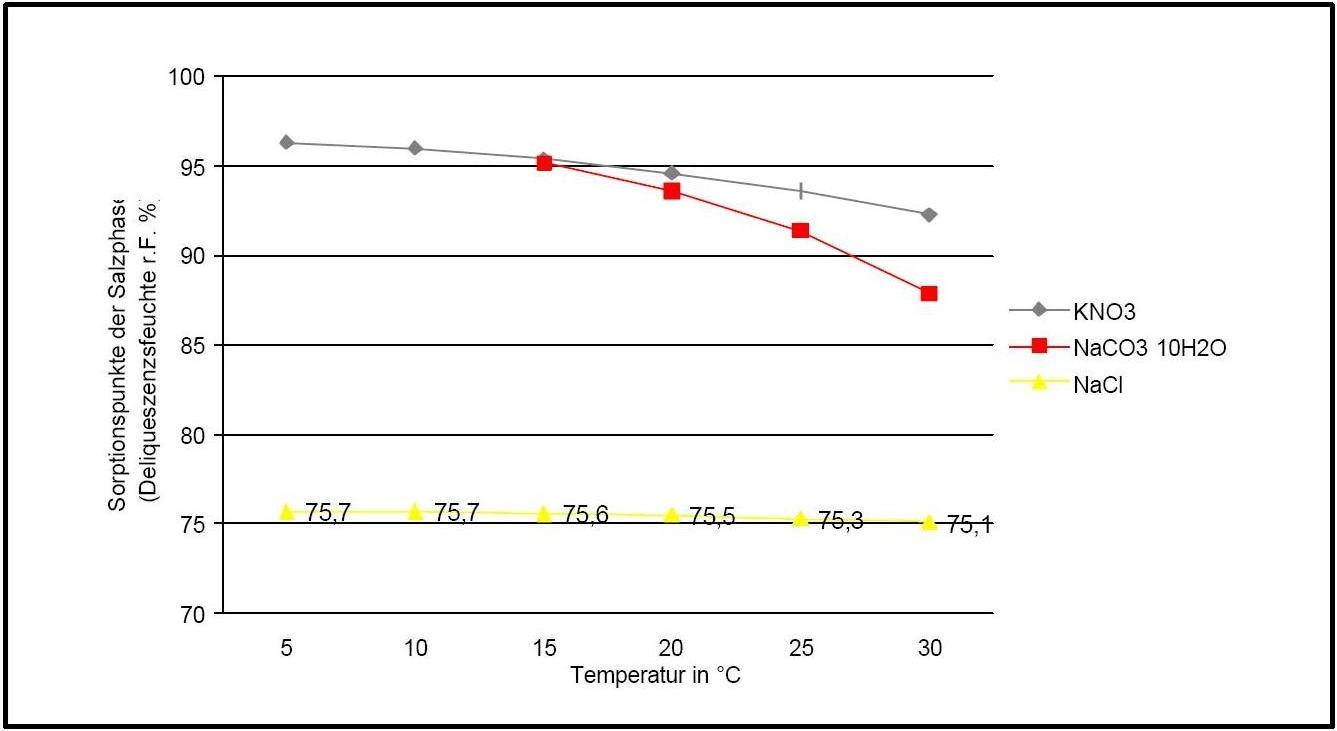
Die Deliqueszenzfeuchte von Kaliumnitrat liegt im Temperaturbereich von 0°C bis 30°C stets über 90% r.F. und ist vergleichsweise linear. Sie wird unter dem Einfluss von Fremdionen allerdings deutlich nach unten verschoben.
| 0°C | 5°C | 10°C | 15°C | 20°C | 25°C | 30°C |
| 96,3%r.F. | 96,3%r.F. | 96%r.F. | 95,4%r.F. | 94,6%r.F. | 93,6%r.F. | 92,3%r.F. |
| MgSO4 | Ca(NO3)2 | Na2SO4 | NaCl | |
| KNO3 | 78% rF | 51% rF | 81% rF | 67% rF |
Feuchtesorption[Bearbeiten]
Die Feuchtesorption von Kaliumnitrat nach 56 Tagen liegt bei einer Lagerungsfeuchte von 87% r.F . erst bei 6 M% (vgl. Tablle 1). Bei niedrigeren Lagerungsfeuchten von 81% oder 79% konnte keine Feuchtesorption festgestellt werden. Unter gleichen Bedingungen konnte mit einer Mischung (1:1) von Kaliumnitrat und Natriuchlorid eine Feuchtesorption bei 87% r.F. von 221 M%, bei 81% r.F. von 130 M% und bei 79% r.F. von 70 M% gemessen werden.[(vgl. Tabelle 1)
| Lagerungsfeuchte | 87%r.F. | 81%r.F. | 79%r.F. |
| KNO3 | 6 | 0 | 0 |
| KNO3 + NaCl (1:1 molare Mischung) | 221 | 130 | 70 |
Analytischer Nachweis[Bearbeiten]
Mikroskopie[Bearbeiten]
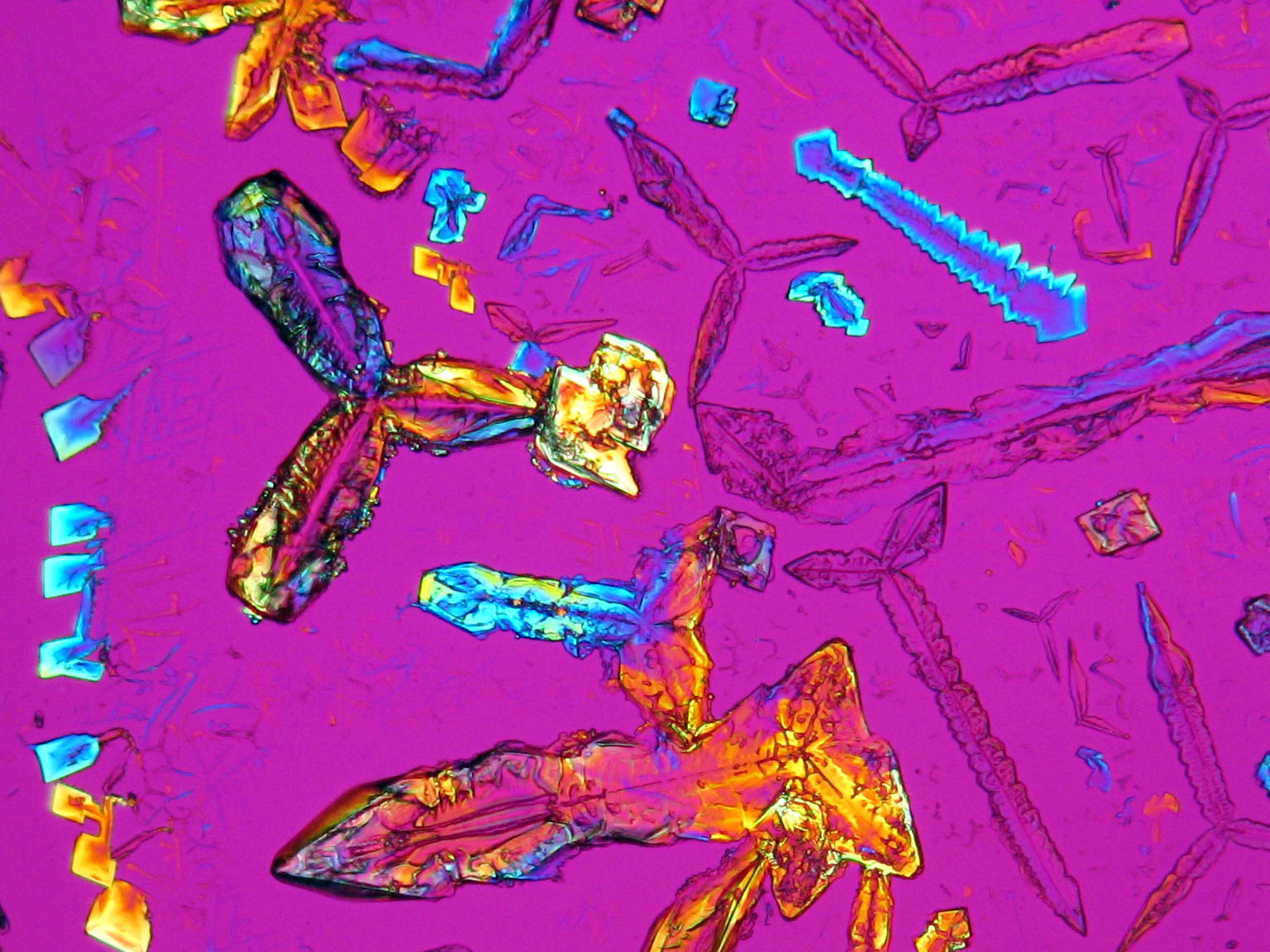
Laboruntersuchung: Bei langsamer Rekristallisation eines überwiegend aus Kaliumnitrat bestehenden Präparates werden tafelig-flache, rhombenförmige Kristalle und lattige oder stäbchenförmige Partikel ausgefällt. Insbesondere zu Beginn der Rekristallisation von Kaliumnitrat aus wässerigen Lösungen wie auch aus Lösungen mit geringem Fremdionenanteil, lässt sich eine charakteristische Bildung rhombenförmiger Kristalle beobachten, die am Lösungstropfenrand entstehen. Unter starkem Einfluss von Fremdionen (bei hoher Fremdionenkonzentration im Ausgangsmaterial) können die oben beschriebenen morphologischen Charakteristika nahezu wegfallen, und es treten unspezifischere Kristallformen des Kaliumnitrates auf. Der pH-Wert von überwiegend kaliumnitrathaltigen Präparaten liegt im neutralen Bereich, die Hygroskopizität ist gering.[Mainusch:2001]Titel: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Autor / Verfasser: Mainusch, Nils
Brechungsindizes: nx = 1,335; ny =1.505; nz =1.506
Doppelbrechung: Δ = max. 0,171
Kristallklasse: orthorhombisch
Polarisationsmikroskopische Untersuchung
Die Zuweisung der Brechungsindizes von Kaliumnitrat erfolgt entsprechend der Immersionsmethode, wobei die Einbettung in Standard-Immersionsöl mit dem Brechungsindex nD=1,518 bereits alle notwendigen Beobachtungen ermöglicht. Aufgrund der hohen maximalen Doppelbrechung zeigt Kaliumnitrat lebhafte Interferenzfarben. Zur korrekten Zuweisung der höchsten Interferenzfarbe empfiehlt es sich, den Rot I -Kompensator zu benutzen.
Die Auslöschung ist parallel oder symmetrisch. Im Regelfall tritt beim Einschwenken in die Normalstellung an elongierten Kristallen eine gut beobachtbare parallele Auslöschung auf. Symmetrische Auslöschung kann an rhombenförmigen Partikeln beobachtet werden.
Die Abbildungen weiter unten veranschaulichen einen Spezialfall im Auslöschungsverhalten an elongierten Kristallen. Was zunächst als eine schiefe Auslöschung gedeutet werden kann, erweist sich bei detaillierter Betrachtung der Einzelkristalle und der Klärung der tatsächlich vorliegenden Symmetrieebenen als parallele und symmetrische Auslöschung.
Verwechslungsmöglichkeiten
Kaliumnitrat ist eindeutig identifizierbar. Die in der nachstehenden Tabelle angegebenen Nitrate weisen Brechungsindizes auf, die denen des Kaliumnitrats ähneln, gleichwohl existieren klare Unterscheidungsmerkmale.
| Salzphase | Unterscheidungsmerkmale zu Kaliumnitrat |
| Nitronatrit NaNO3 | |
| Nitromagnesit Mg(NO3)2 • 6H2O | schiefe Auslöschung/ hygroskopisch |
| Nitrocalcit Ca(NO3)2 • 4H20 | deutlich niedrigere Doppelbrechung/schiefe Auslöschung/hygroskopisch |
Betrachtung von Mischsystemen (nach [Mainusch:2001]Titel: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Autor / Verfasser: Mainusch, Nils )
)
Im Mischsystem K+-NO32-– Ca2+-SO42- werden aufgrund des hohen Fremdionenanteils stark verwachsene KNO3-Kristalle ausgebildet. Die Tendenz, in großteiligen und länglich geformten Partikeln zu kristallisieren, bleibt beim Kaliumnitrat bestehen. Verfolgt man den Prozess der Rekristallisation, so ist die zeitlich frühere Bildung von Gipskristallen klar nachzuvollziehen. Im vorliegenden, komplexen Mischsystem werden neben Kaliumnitrat und Gips als Hauptkomponenten noch andere Salzphasen wie Kaliumsulfat und Kalium-Calcium-Doppelsalze gebildet (Calciumnitrat konnte nicht festgestellt werden). Der Nachweis aller Salzphasen, die in diesem Mischsystem entstehen können, ist mit einigem Aufwand bei der Trennung und Präparation verbunden. Hilfreich ist es, sich bei der Präparation und der Trennung die Unterschiede der Wasser- und Ethanollöslichkeiten der Salze zunutze zu machen.
Bei der Betrachtung des zweiten Mischsystems (K+-NO32- – Na+- Cl-) zeigt sich, daß der Ausfall von gut ausgebildeten KNO3-Einzelkristallen kurz vor der Bildung isotroper Halitkristalle einsetzt. Dies entspricht den geringfügigen Löslichkeitsunterschieden der beiden Salze. Als Produkte ist es möglich, Kaliumnitrat und Halit nachzuweisen.
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikroskop[Bearbeiten]
- KNO3 kristallisiert aus wässriger Lösung auf einem Objektträger
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Mainusch:2001] | Mainusch, Nils (2001): Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung, Diplomarbeit, HAWK Hochschule für angewandte Wissenschaft und Kunst Hildesheim/Holzminden/Göttingen, file:Diplomarbeit Nils Mainusch.pdf |   |
| [Robie.etal:1978] | Robie R.A., Hemingway B.S.; Fisher J.A. (1978): Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures. In: U.S. Geol. Surv. Bull, 1452 () |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (Hrsg.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, Webadresse, https://doi.org/10.1007/978-3-642-45155-3_4. |  |
| [Vogt.etal:1993] | Vogt, R.; Goretzki, Lothar (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht. |  |