Was sind Salze?
Autoren: Hans-Jürgen Schwarz
zurück zu Grundlagen
Abstract[Bearbeiten]
Salze bestehen aus Metallkationen (z. B. K+, Ca2+) oder einer basischen Atomgruppe (z.B. NH4+) und Säurerestanionen (z.B Nitrat), die durch eine Ionenbindung zusammengehalten werden. Sie sind kristallin.
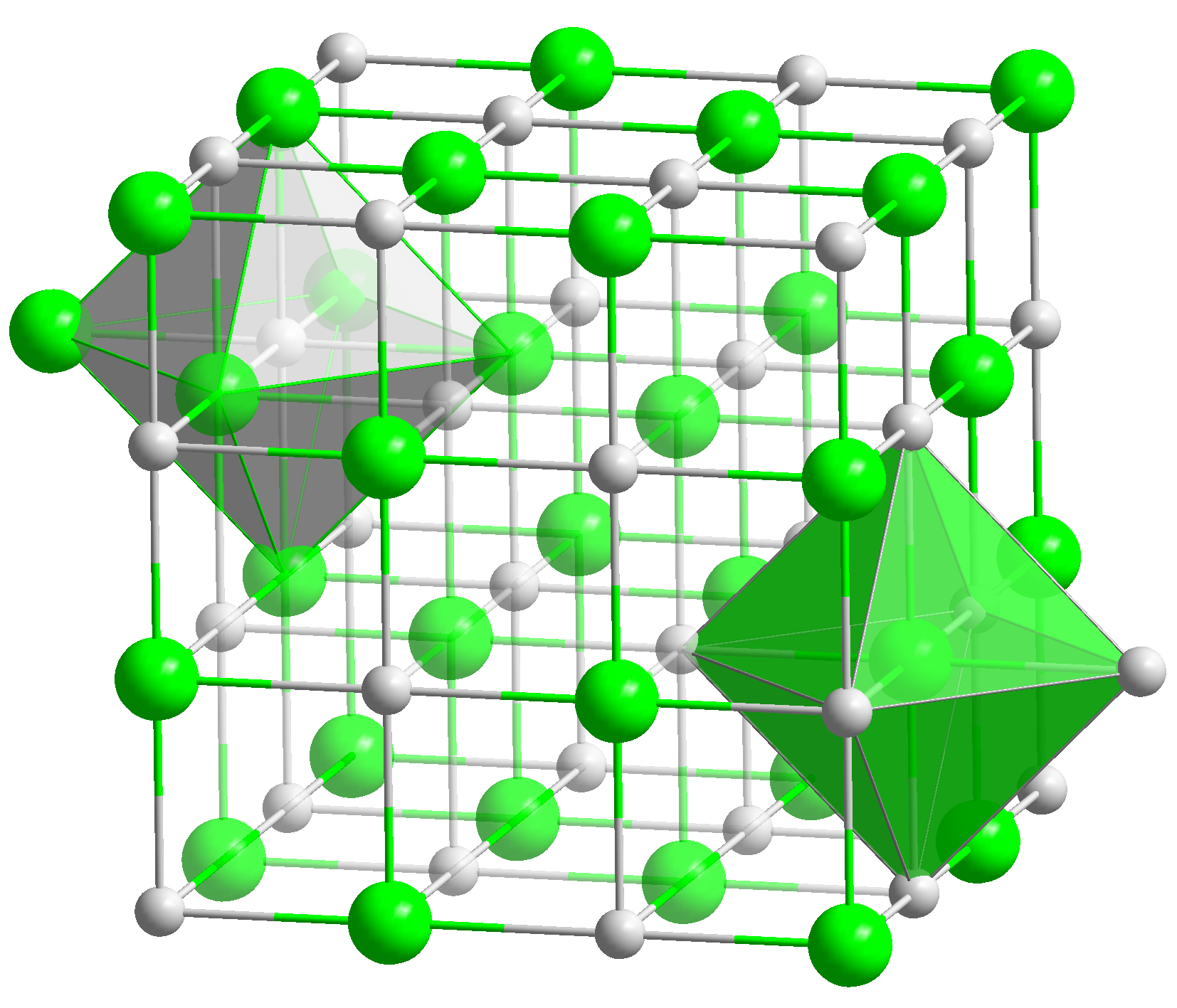
Aufbau der Salze[Bearbeiten]
Salze [1] bestehen in der Regel aus positiv geladenen Ionen, den Kationen, und negativ geladenen Ionen, den Anionen, die ein Kristallgitter aufbauen. Zusätzlich findet sich im Kristallgitter oft noch Wasser (H2O).
Salze entstehen z. B. bei der Neutralisationsreaktion, d. h. beim Zusammentreffen einer Säure mit einer Base.
Fehler beim Parsen (SVG (MathML kann über ein Browser-Plugin aktiviert werden): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle Na^+ + OH^- + H_3O^+ + Cl^- \rightarrow NaCl + 2H_2O}
Base + Säure → Salz + Wasser
Bei der Reaktion einer Säure mit einer Base entsteht nicht immer ein neutrales Salz. Es gibt auch basische und saure Salze, je nachdem, wie stark die Säuren bzw. Basen sind, die an der Reaktion beteiligt sind:
1. starke Säure + starke Base → neutrales Salz + H2O
2. starke Säure + schwache Base → saures Salz + H2O
3. schwache Säure + starke Base → basisches Salz + H2O
z.B.
1. Fehler beim Parsen (SVG (MathML kann über ein Browser-Plugin aktiviert werden): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle H_3O^+ + Cl^- + Na^+ + OH^- \rightarrow NaCl + H_2O }
2. Fehler beim Parsen (SVG (MathML kann über ein Browser-Plugin aktiviert werden): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle H_3O^+ + Cl^- + NH_3 \rightarrow NH_4Cl + H_2O }
3. Fehler beim Parsen (SVG (MathML kann über ein Browser-Plugin aktiviert werden): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle H_3O^ + HCO_3^- + 2Na^+ + 2OH^- \rightarrow Na_2CO_3 + 3H_2O }
Die Formel von Salzen schreibt man:
(positives Ion (Kation))X (negatives Ion (Anion))Y • nH2O : z.B. CaCl2 • 6 H2O
mit x,y,n Zahl der Ionen bzw. Wassermoleküle
| Salze bestehen aus Metallkationen oder einer basischen Atomgruppe und Säurerestanionen, die durch eine Ionenbindung zusammengehalten werden. Sie sind kristallin. |
Welche Ionen bauen die Salze auf?[Bearbeiten]
Bauschädlichen Salze[Bearbeiten]
Die bauschädlichen Salze bestehen zu über 90% aus den
Anionen
- Sulfat SO42-
- Nitrat NO3-
- Chlorid Cl-
- Carbonat CO32-
und den Kationen
- Natrium Na+
- Kalium K+
- Calcium Ca2+
- Magnesium Mg2+
weitere Anionen sind:
- Acetat CH3COO-
- Formiat HCOO-
- Oxalat C2O42-
- Phosphat PO43-
weitere Kationen sind:
- Ammonium NH4+
Eigenschaften der Salze[Bearbeiten]
Salze besitzen Eigenschaften, die ihr Verhalten in Lösung und auch als Schadsalz an den Objekten erklären helfen.
Zu diesen Eigenschaften gehören:
- Löslichkeit
- Deliqueszenzfeuchte
- Elektrische Leitfähigkeit
- Wärmeleitfähigkeit
- Festigkeit
- Dichte
- Härte
- Schmelzpunkt
- Wärmedehnung
- Farbe
- Glanz
- Lumineszenz
Dichte:[Bearbeiten]
Die Dichte ist eine ortsunabhängige Konstante jedes Minerals und wird in [g/cm3] angegeben. Sie gilt nur für eine bestimmte Mineralphase; Umwandlungen zu anderen Modifikationen verändern die Dichte, so z.B.:
Calcit (trigonal) : 2.71 g/cm³ Aragonit (rhombisch) : 2.04 g/cm³
Festigkeit:[Bearbeiten]
Neben der Dichte gehören zu den mechanischen Eigenschaften der Salze/Mineralien die Festigkeit und die Härte. In beiden Fällen sind Kohäsionseigenschaften angesprochen, die in erster Linie von der Bindungsart und der Bindungsstärke der Bauteile im Kristallgitter abhängen und somit in besonderem Maße der Anisotropie unterliegen. Kohäsionseigenschaften sind zum anderen in besonderem Maße von Kristallfehlern in den Realkristallen abhängig, d.h. Messungen von Festigkeiten und Härten weichen in der Regel von theoretischen Werten stark ab. Wie die meisten Minerale sind auch die Salze ausgesprochen spröde. Bricht ein Kristall, so kann es zu unregelmäßigen, muscheligen und splitterigen Bruchflächen aber auch zu ebenen Flächen, den sogenannten Spaltbarkeitsflächen kommen. Besonders gut lassen sich die Spaltflächen bei den Mineralien beobachten, die im deutschen Sprachgebrauch die Endung -spat haben (Kalkspat, Schwerspat, Feldspat). Die Spaltbarkeit hat ihre Ursache in der Kristallstruktur; sie ist längs solcher Netz- oder Kristallgitterebenen am leichtesten möglich, die eine besonders dichte Besetzung haben und zwischen denen die geringste Bindungen je Flächeneinheit bestehen. So sind Spaltbarkeiten entlang von Ebenen, die aneinander durch Wasserstoffbrückenbindung oder Van der Waals-Kräfte gebunden sind, zumeist besonders vollkommen ausgebildet. Insbesondere, wenn bei der mechanischen Beanspruchung eine Verschiebung der Netzebenen derart erfolgt, dass sich gleichgeladene Bausteine gegenüber stehen, so dass eine Abstoßung erreicht wird.
Solche Netzebenen sind meist auch gleichzeitig wichtige Kristallflächen, weshalb die Spaltbarkeit die Symmetrie und Feinstruktur des Minerals widerspiegeln. Besonders schön ist die Spaltbarkeit in Form der Spaltrisse beim mikroskopischen Studium der Minerale zu beobachten.
Die Härte der Mineralien:[Bearbeiten]
Eingriffe in die Oberfläche eines Minerals können durch Ritzen, Eindrücken eines Stempels, Schleifen oder auch Hobeln geschehen. Daraus ergeben sich mehrere verschieden definierten Härtearten, die mit unterschiedlichen Methoden erfasst und gemessen werden. Die Messwerte können jedoch nur indirekt miteinander verglichen werden.
Die Standardmethode in der Mineralogie ist eine Ritzmethode, die sog. Ritzhärte nach Mohs. Er definierte anhand von 10 Mineralien eine Härteskala von 1-10 mit:
| Härte | Mineral | Härte | Mineral |
| 1 | Talk | 6 | Kalifeldspat |
| 2 | Gips | 7 | Quarz |
| 3 | Kalkspat | 8 | Topas |
| 4 | Flußspat | 9 | Korund |
| 5 | Apatit | 10 | Diamant |
Die bei der Ritzhärte zu beachtende Anisotropie kommt bei der relativ groben Gliederung nach MOHS nur selten zum tragen (z.B. Al2SiO5 - Disten).
Schmelzpunkt[Bearbeiten]
Die bauschädlichen meist hygroskopischen Salze schmelzen nicht. Entweder zersetzen sie sich, bevor sie aufschmelzen würden, oder es finden Phasenumwandlungen in andere Minerale statt, so dass eine Schmelze nie die Zusammensetzung des Salzes hat.
Wärmeleitfähigkeit[Bearbeiten]
Sie ist im Kristall richtungsabhängig und verhält sich in bezug auf die kristallographische Orientierung wie das Licht. Richtungen dichter Atompackungen haben eine relativ stärkere Leitfähigkeit als Richtungen weniger dichter Atompackungen. So sind in den einzelnen Kristallsystemen unterschiedliche Verhältnisse anzutreffen. In amorphen Festkörpern hingegen findet man eine isotrope Wärmeleitfähigkeit (Wärmeleitung in alle Richtungen des Raumes mit der selben Geschwindigkeit), da eine Fernordnung fehlt und nur eine Nahordnung der Bausteine ausgeprägt ist.
Wärmedehnung[Bearbeiten]
Wie fast alle Stoffe zeigen auch die Mineralien bei Erwärmung eine räumliche Ausdehnung. Diese thermische Dilatation ist bei Kristallen jedoch sehr viel niedriger als bei Flüssigkeiten. Auch die Wärmedehnung ist der Anisotropie unterworfen, d.h. Mineralkörner dehnen sich bei Erwärmung in verschiedenen Richtungen verschieden stark aus. Manche Minerale besitzen in einer Richtung sogar eine negative Ausdehnung, d.h. sie ziehen sich zusammen. Die ungleiche Verformung von Kristallen bei Temperaturveränderungen ist Hauptursache der sog. Temperaturverwitterung. In der Technik kann durch gezielte Steuerung von Abkühlung einer Glasmasse und Keimbildung und Kristallwachstum eine Glaskeramik erzeugt werden mit einer Wärmedehung von praktisch Null.
Elektrische Leitfähigkeit[Bearbeiten]
Die Leitfähigkeit bei Ionenkristallen ist als Ionenleitung zu verstehen. Dies geschieht durch die Wanderung von Kristalldefekten. Das heißt, es findet keine Leitung statt, wenn ein idealer Kristall vorliegt. Da jedoch Kristalldefekte (Punktfehlstellen) eine thermodynamische Größe sind (Gleichgewichtskonzentration), deren Konzentration abhängig von Druck, Temperatur und Kristallzusammensetzung ist, gibt es nahezu keine idealen Kristalle. Thermische Schwingungen der Kristallbausteine um die Ruhelage des idealen Gitterplatzes führen dazu, das einige ihren Gitterplatz verlassen und unter Hinterlassung einer Leerstelle auf einen Zwischengitterplatz oder die Oberfläche wandern. Die Zahl der Fehlstellen wächst mit zunehmender Temperatur. Transportvorgänge, also die Wanderung von Fehlstellen (Ionenleitung) können nur bei hohen Temperaturen stattfinden, da erst dann die Defektkonzentration und die thermische Energie der Ionen groß genug ist, um Leitfähigkeit zu erzeugen (Halbleitereigenschaft).
Nur in gelöstem Zustand sind die nun im hydatisierten Zustand in Lösung vorliegenden Ionen gute elektrische Leiter, Ionenleiter.
Farbe[Bearbeiten]
Die Farbe der Minerale spielt für die Salze, die in unserem Falle ausnahmslos weiß sind, keine Rolle. An dieser Stelle sei nur darauf hingewiesen, dass es eigenfarbige (idiochromatische) Minerale gibt, deren Farben durch farbgebende Elemente (Chromophoren) wie Cr, Mn, Fe, Cu, usw) ein wichtiges Charakteristikum des Minerals ist, wie auch allochromatische Minerale, die ihre Farbe durch den Einbau von farbgebenden idiochromatischen Farbpartikeln oder den Einbau bestimmter Spurenelemente ins Gitter erhalten. Diese fremdbestimmten Farben sind untypisch für das Mineral und kann für ein und dasselbe Mineral sehr unterschiedlich sein. Bei anisotropen Mineralen ist natürlich auch die Farbe des Minerals von der Richtung abhängig. Dieser Effekt, der Pleochroismus, ist bei manchen Mineralien deutlich ausgeprägt.
Glanz[Bearbeiten]
Der Glanz der Minerale ist ein optischer Effekt, der in erster Linie durch Lichtbrechung und Reflexion erzeugt wird. Hohe Lichtbrechungen und Reflexionen erzeugen in der Regel auch einen starken Glanz, der auch als Metall, Diamant-, oder Glasglanz beschrieben werden kann. Auch die spezielle Form der Oberfläche beeinflusst den Glanz (Fettglanz, Seidenglanz, Perlmuttglanz).
Lumineszenz[Bearbeiten]
Als Lumineszenz (lat. lumen = kaltes Licht) wird eine Eigenschaft von Mineralien bezeichnet, die auf die Umsetzung von zugeführter Energie in sichtbares Licht basiert. Radiolumineszenz: Anregung durch radioaktive Strahlung. Thermolumineszenz: Anregung durch Zufuhr von Wärme. UV-Fluoreszenz: Anregung durch UV-Licht. Die Phosphoreszenz ist eine Lichterscheinung an Mineralien, die über die Dauer der Energiezufuhr weiter besteht. Sie ist ein stark temperaturabhängiger Vorgang, wobei die Energie nach der Anregung in Zwischenniveaus gespeichert wird und die Lichtaussendung (Emmision) erst durch Temperaturerhöhung ausgelöst wird. Die Verweilzeit der angeregten Elektronen auf höherem Niveau ist länger, so dass sich das Leuchten einige Zeit nach Abschalten der Anregerstrahlung fortsetzt und dann langsam ausklingt.
Die Konsequenzen aus der Doppelbrechung, den unterschiedlichen Lichtbrechungen der Mineralien und der anderen optischen Eigenschaften werden zur Bestimmung der Minerale mit dem Polarisationsmikroskop ausgenutzt und im entsprechenden Kapitel näher behandelt.