Calciumchlorid: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| (2 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 11: | Zeile 11: | ||
==Hydratstufen== | ==Hydratstufen== | ||
[[Sinjarit]]: CaCl<sub>2</sub>•2H<sub>2</sub>O <br> [[Calciumchlorid-Tetrahydrat]]: CaCl<sub>2</sub>•4H<sub>2</sub>O <br> [[Antarcticit]]: CaCl<sub>2</sub>•6H<sub>2</sub>O | [[Calciumchlorid-Monohydrat]]: CaCl<sub>2</sub>•H<sub>2</sub>O <br> [[Sinjarit]]: CaCl<sub>2</sub>•2H<sub>2</sub>O <br> [[Calciumchlorid-Tetrahydrat]]: CaCl<sub>2</sub>•4H<sub>2</sub>O <br> [[Antarcticit]]: CaCl<sub>2</sub>•6H<sub>2</sub>O | ||
==Lösungsverhalten== | ==Lösungsverhalten== | ||
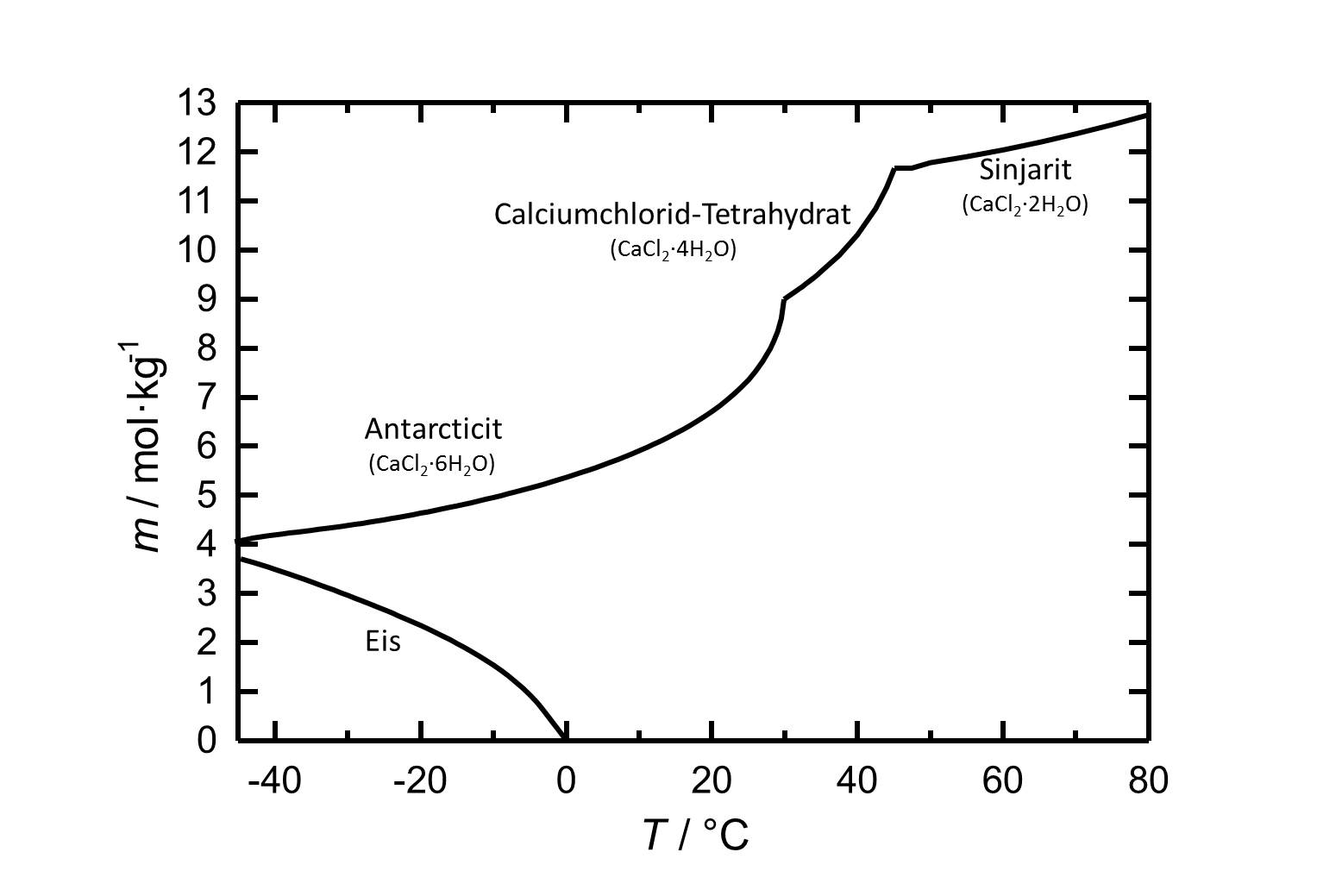
[[Image:L CaCl2 deu.jpg|thumb| | [[Image:L CaCl2 deu.jpg|thumb|left|600px|Abbildung 1: Löslichkeit von Calciumchlorid in Wasser, aufgetragen ist die Molalität ''m'' [n(CaCl<sub>2</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] | ||
<br clear=all> | <br clear=all> | ||
Unter Standardbedingungen liegt das Hexahydrat des Calciumchlorids, [[Antarcticit]], vor. Das Salz weißt eine hohe Löslichkeit in Wasser auf, die mit steigernder Temperatur zunimmt. Die Dehydratisierung zum [[Calciumchlorid-Tetrahydrat]] erfolgt bei etwa 30°C, die zu [[Sinjarit]] bei etwa 45 °C. | Unter Standardbedingungen liegt das Hexahydrat des Calciumchlorids, [[Antarcticit]], vor. Das Salz weißt eine hohe Löslichkeit in Wasser auf, die mit steigernder Temperatur zunimmt. Die Dehydratisierung zum [[Calciumchlorid-Tetrahydrat]] erfolgt bei etwa 30°C, die zu [[Sinjarit]] bei etwa 45 °C. | ||
| Zeile 21: | Zeile 21: | ||
==Hygroskopizität== | ==Hygroskopizität== | ||
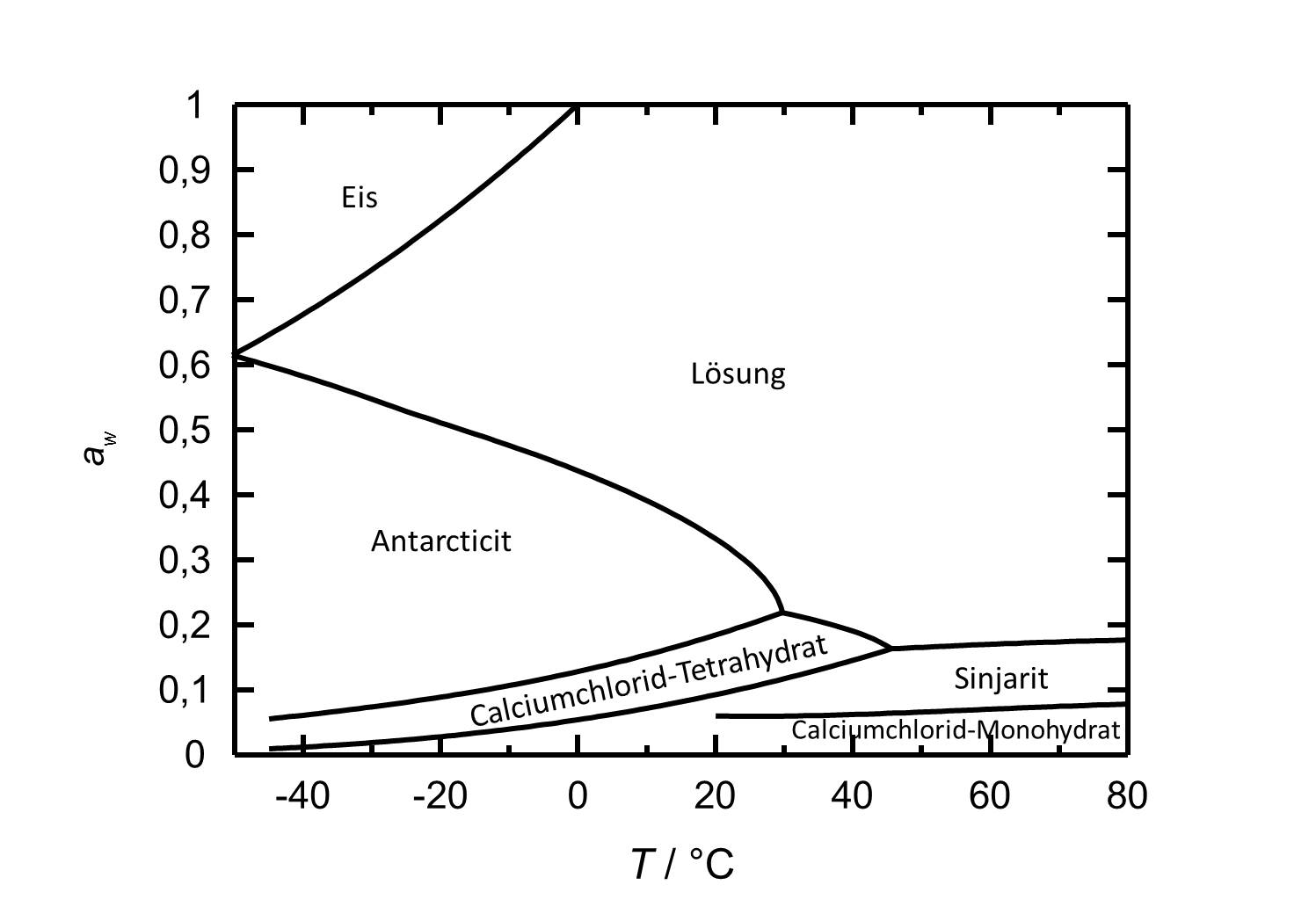
[[Image:D CaCl2 d.jpg|thumb|left| | [[Image:D CaCl2 d.jpg|thumb|left|600px|Abbildung 2: Deliqueszenzverhalten von Calciumchlorid in Abhängigkeit der Temperatur. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur.]] | ||
<br clear=all> | <br clear=all> | ||
Bei den verschiedenen Phasen des Calciumchlorids handelt es sich um hygroskopische Salze mit vergleichsweise niedrigen Deliqueszenzfeuchten. Bei Raumtemperatur weist das vorliegende [[Antarcticit]] eine Deliqueszenzfeuchte von etwa 30 % auf. Das Deliqueszenzverhalten ist insofern temperaturabhängig, als dass bei höheren Temperaturen niedrigere Deliqueszenzfeuchten vorliegen. Bei einer Temperatur von 20 °C kommt es bei einer relativen Luftfeuchte von 18 % zur Dehydratisierung zum Calciumchlorid-Tetrahydrat. Bei 9 % RH beziehungsweise 6 % RH bildet sich das Di- ([[Sinjarit]]) beziehungsweise das Monohydrat. | Bei den verschiedenen Phasen des Calciumchlorids handelt es sich um hygroskopische Salze mit vergleichsweise niedrigen Deliqueszenzfeuchten. Bei Raumtemperatur weist das vorliegende [[Antarcticit]] eine Deliqueszenzfeuchte von etwa 30 % auf. Das Deliqueszenzverhalten ist insofern temperaturabhängig, als dass bei höheren Temperaturen niedrigere Deliqueszenzfeuchten vorliegen. Bei einer Temperatur von 20 °C kommt es bei einer relativen Luftfeuchte von 18 % zur Dehydratisierung zum Calciumchlorid-Tetrahydrat. Bei 9 % RH beziehungsweise 6 % RH bildet sich das Di- ([[Sinjarit]]) beziehungsweise das Monohydrat. | ||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="30%" align="left" class="wikitable" | |||
|+''Tabelle 1: Deliqueszenz- und Gleichgewichtsfeuchten bei 20 °.'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| '''Betrachtete Phasenübergänge''' | |||
|bgcolor = "#F0F0F0" align=center| '''Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C''' | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Antarcticit]]-Lösung | |||
|bgcolor = "#FFFFEO" align=center| 33,3 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Antarcticit]]-[[Calciumchlorid-Tetrahydrat]] | |||
|bgcolor = "#FFFFEO" align=center| 18,5 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Calciumchlorid-Tetrahydrat]]-[[Sinjarit]] | |||
|bgcolor = "#FFFFEO" align=center| 9 % | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| [[Sinjarit]]-[[Calciumchlorid-Monohydrat]] | |||
|bgcolor = "#FFFFEO" align=center| 6 % | |||
|} | |||
<br clear="all"> | |||
==Einzelnachweise== | ==Einzelnachweise== | ||
Aktuelle Version vom 3. Mai 2023, 11:55 Uhr
Autor: Amelie Stahlbuhk
zurück zu Chloride
| Dieser Artikel wird gerade neu erstellt und ist noch nicht vollständig. |
Abstract[Bearbeiten]
Die verschiedenen Hydratstufen des Calciumchlorids sollen kurz vorgestellt werden, sowie ihr Verhalten bezüglich Löslichkeit und Hygroskopizität besprochen werden.
Hydratstufen[Bearbeiten]
Calciumchlorid-Monohydrat: CaCl2•H2O
Sinjarit: CaCl2•2H2O
Calciumchlorid-Tetrahydrat: CaCl2•4H2O
Antarcticit: CaCl2•6H2O
Lösungsverhalten[Bearbeiten]
Unter Standardbedingungen liegt das Hexahydrat des Calciumchlorids, Antarcticit, vor. Das Salz weißt eine hohe Löslichkeit in Wasser auf, die mit steigernder Temperatur zunimmt. Die Dehydratisierung zum Calciumchlorid-Tetrahydrat erfolgt bei etwa 30°C, die zu Sinjarit bei etwa 45 °C.
Hygroskopizität[Bearbeiten]
Bei den verschiedenen Phasen des Calciumchlorids handelt es sich um hygroskopische Salze mit vergleichsweise niedrigen Deliqueszenzfeuchten. Bei Raumtemperatur weist das vorliegende Antarcticit eine Deliqueszenzfeuchte von etwa 30 % auf. Das Deliqueszenzverhalten ist insofern temperaturabhängig, als dass bei höheren Temperaturen niedrigere Deliqueszenzfeuchten vorliegen. Bei einer Temperatur von 20 °C kommt es bei einer relativen Luftfeuchte von 18 % zur Dehydratisierung zum Calciumchlorid-Tetrahydrat. Bei 9 % RH beziehungsweise 6 % RH bildet sich das Di- (Sinjarit) beziehungsweise das Monohydrat.
| Betrachtete Phasenübergänge | Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C |
| Antarcticit-Lösung | 33,3 % |
| Antarcticit-Calciumchlorid-Tetrahydrat | 18,5 % |
| Calciumchlorid-Tetrahydrat-Sinjarit | 9 % |
| Sinjarit-Calciumchlorid-Monohydrat | 6 % |
Einzelnachweise[Bearbeiten]
Literatur[Bearbeiten]
Es wurden keine Zitate im Artikel gefunden.