Thecotrichite: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
|||
| (65 dazwischenliegende Versionen von 5 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: | Autoren: [[user:KLinnow|Kirsten Linnow]] | ||
<br>zurück zu [[SalzWiki:Organische Salze |Organische Salze]] | |||
{| | {{Infobox_Salz | ||
| | |Footnote=<ref> http://iaq.dk/iap/iap1998/1998_04.htm&lt;br&gt;</ref> | ||
|bild =[[Image:Thecotrichite 19082010-9.jpg|300px]] | |||
|mineralogischerName=Thecotrichite | |||
|chemischerName =Tricalciumtriacetatchloriddinitrat Heptahydrat | |||
| | |Trivialname = | ||
| | |chemFormel =Ca<sub>3</sub>(CH<sub>3</sub>COO)<sub>3</sub>Cl(NO<sub>3</sub>)<sub>2</sub>•7H<sub>2</sub>O | ||
|Hydratformen = | |||
| | |Kristallsystem = | ||
|Deliqueszenzfeuchte =85% | |||
| | |Löslichkeit= | ||
|Dichte = | |||
|Molvolumen = | |||
|Molgewicht =582.936 g/mol | |||
|Transparenz = | |||
|Spaltbarkeit = | |||
|Kristallhabitus = | |||
|Zwillingsbildung = | |||
|Brechungsindices =n<sub>x</sub> = 1.491 ± 0.001<br>n<sub>z</sub> = 1.494 ± 0.003<!--<bib id=Halsberghe.etal:/>--> | |||
|Doppelbrechung = | |||
| | |optOrientierung= | ||
|Pleochroismus = | |||
|Dispersion = | |||
| | |Phasenübergang = | ||
| Deliqueszenzfeuchte | |chemVerhalten = | ||
|Bemerkungen =gefunden auf kalkhaltigen Museumsobjekten | |||
| | |Literatur = [[File:Poster Thecotrochite-Linnov-etal.pdf]] | ||
| Dichte | }} | ||
| Molvolumen | |||
| Molgewicht | |||
| Transparenz | |||
| Spaltbarkeit | |||
| Kristallhabitus | |||
| Zwillingsbildung | |||
| Brechungsindices | |||
| | |||
| | |||
| Pleochroismus | |||
| Dispersion | |||
| | |||
| | |||
| | |||
| | |||
< | <!-- == Abstract == --> | ||
< | == '''Phasendiagramm des quaternären System Ca(CH'''<sub>'''3'''</sub>'''COO)'''<sub>'''2'''</sub>'''–CaCl'''<sub>'''2'''</sub>'''–Ca(NO'''<sub>'''3'''</sub>''')'''<sub>'''2'''</sub>'''–H'''<sub>'''2'''</sub>'''O''' == | ||
<br> | [[Datei:Phasendiagramm_Thecotrichit_25GradC.jpg|thumb|left|400px|Die Nummer eines Stabilitätsfeldes verweist auf die Salzphase, die im Gleichgewicht mit den gesättigten Lösungen eines Stabilitätsfeldes stehen wie folgt:<br/> | ||
(1) CaCl<sub>2</sub> • 6H<sub>2</sub>O, (2) CaCl<sub>2</sub> • 4H<sub>2</sub>O, (3) CaCl(NO<sub>3</sub>) • 2H<sub>2</sub>O, (4) Ca(NO<sub>3</sub>)<sub>2</sub> • 3H<sub>2</sub>O, (5) Ca(NO<sub>3</sub>)<sub>2</sub> • 4H<sub>2</sub>O, (6) Ca<sub>2</sub>(CH<sub>3</sub>COO)<sub>3</sub>(NO<sub>3</sub>) • 2H<sub>2</sub>O, (7) Ca(CH<sub>3</sub>COO)<sub>2</sub> • H<sub>2</sub>O, (8) Ca(CH<sub>3</sub>COO)Cl • 5H<sub>2</sub>O, (9) Ca<sub>3</sub>(CH<sub>3</sub>COO)<sub>3</sub>Cl(NO<sub>3</sub>)<sub>2</sub> • 7H<sub>2</sub>O.<br/> | |||
< | Punkt T im Phasendiagramm repräsentiert die Zusammensetzung des Tripelsalzes Thecotrichite (Ca<sub>3</sub>(CH<sub>3</sub>COO)<sub>3</sub>Cl(NO<sub>3</sub>)<sub>2</sub> • 7H<sub>2</sub>O).]] | ||
< | Das isotherme Phasendiagramm des quaternären Systems Ca(CH<sub>3</sub>COO)<sub>2</sub>–CaCl<sub>2</sub>–Ca(NO<sub>3</sub>)<sub>2</sub>–H<sub>2</sub>O (25°C)<bib id="Linnow:2007"/> ist als Jännecke Projektion auf die wasserfreie Ebene abgebildet. Alle Lösungszusammensetzungen werden als Stoffmengenverhältnis von Ca(CH<sub>3</sub>COO)<sub>2</sub>, CaCl<sub>2 </sub>und Ca(NO<sub>3</sub>)<sub>2</sub> angegeben. Die Ecken des Dreiecks repräsentieren die reinen Salze, die Seiten repräsentieren die drei ternären Randsysteme Ca(CH<sub>3</sub>COO)<sub>2</sub>–CaCl<sub>2</sub>–H<sub>2</sub>O, Ca(CH<sub>3</sub>COO)<sub>2</sub>–Ca(NO<sub>3</sub>)<sub>2</sub>–H<sub>2</sub>O und CaCl<sub>2</sub>–Ca(NO<sub>3</sub>)<sub>2</sub>–H<sub>2</sub>O und die innere Fläche repräsentiert alle Lösungszusammensetzungen an denen alle drei Salze beteiligt sind. | ||
Die inneren Linien begrenzen die Stabilitätsfelder einer Salzphase. Die Stabilitätsfelder repräsentieren alle Lösungszusammensetzungen die bezüglich nur einer einzelnen Salzphase gesättigt sind, während die univarianten Linien die Lösungszusammensetzungen repräsentieren bei denen zwei Salzphasen im Gleichgewicht mit der Lösung stehen. | |||
Gemäß der Gibbs´schen Phasenregel können im quaternären System maximal drei verschiedenen Salzphasen im Lösungsgleichgewicht miteinander existieren. Daraus folgt, dass es für jede mögliche Kombination von drei Salzphasen als Bodenkörper nur eine mögliche Zusammensetzung der gesättigten Lösung gibt. Diese Lösungszusammensetzungen werden durch die Schnittpunkte der univarianten Linien repräsentiert. | |||
< | <!-- | ||
== Vorkommen von Thecotrichite<br> == | |||
<br> | <br> | ||
== <br> Angaben zu Herkunft und Bildung von Thecotrichite an Objekten<br> == | |||
= Angaben zum Schadenspotential und zur Verwitterungsaktivitätvon Thecotrichite<br> = | |||
== Lösungsverhalten == | |||
== Hygroskopizität == | == Hygroskopizität == | ||
| Zeile 123: | Zeile 83: | ||
|- | |- | ||
| '''Salzphase''' | | '''Salzphase''' | ||
| <font color="#818181">'''Unterscheidungsmerkmale zu | | <font color="#818181">'''Unterscheidungsmerkmale zu Thecotrichite'''</font> | ||
|- | |- | ||
| <br> | | <br> | ||
| Zeile 134: | Zeile 94: | ||
== Röntgendiffraktometrie == | == Röntgendiffraktometrie == | ||
== Raman- | == Raman-Spektroskopie == | ||
== DTA / TG == | == DTA / TG == | ||
| Zeile 140: | Zeile 100: | ||
== IR-Spektroskopie == | == IR-Spektroskopie == | ||
= Umgang mit | = Umgang mit Thecotrichiteschäden = | ||
= Salze und Salzschäden im Bild = | = Salze und Salzschäden im Bild = | ||
| Zeile 148: | Zeile 108: | ||
== Unter dem Polarisationsmikrokop == | == Unter dem Polarisationsmikrokop == | ||
== Unter dem Rasterelektronenmikroskop == | == Unter dem Rasterelektronenmikroskop ==--> | ||
<br><br><br><br><br><br> | |||
== Weblinks == | |||
<references/> | |||
= Literatur = | == Literatur == | ||
< | <biblist/> | ||
[[Category: Thecotrichite]] | [[Category:Thecotrichite]] [[Category:Acetate]][[Category:Linnow,Kirsten]] [[Category:R-MSteiger]] [[Category:Bearbeitung]] [[Category:Organ. Salze]] [[Category:Salz]][[Category:Liste]] | ||
Aktuelle Version vom 12. Mai 2023, 12:56 Uhr
Autoren: Kirsten Linnow
zurück zu Organische Salze
| Thecotrichite[1] | |

| |
| Mineralogische Salzbezeichnung | Thecotrichite |
| Chemische Bezeichnung | Tricalciumtriacetatchloriddinitrat Heptahydrat |
| Trivialname | |
| Chemische Formel | Ca3(CH3COO)3Cl(NO3)2•7H2O |
| Hydratformen | |
| Kristallsystem | |
| Deliqueszenzfeuchte 20°C | 85% |
| Löslichkeit(g/l) bei 20°C | |
| Dichte (g/cm³) | |
| Molares Volumen | |
| Molare Masse | 582.936 g/mol |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | gefunden auf kalkhaltigen Museumsobjekten |
| Kristalloptik | |
| Brechungsindices | nx = 1.491 ± 0.001 nz = 1.494 ± 0.003 |
| Doppelbrechung | |
| Optische Orientierung | |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| Datei:Poster Thecotrochite-Linnov-etal.pdf | |
Phasendiagramm des quaternären System Ca(CH3COO)2–CaCl2–Ca(NO3)2–H2O[Bearbeiten]
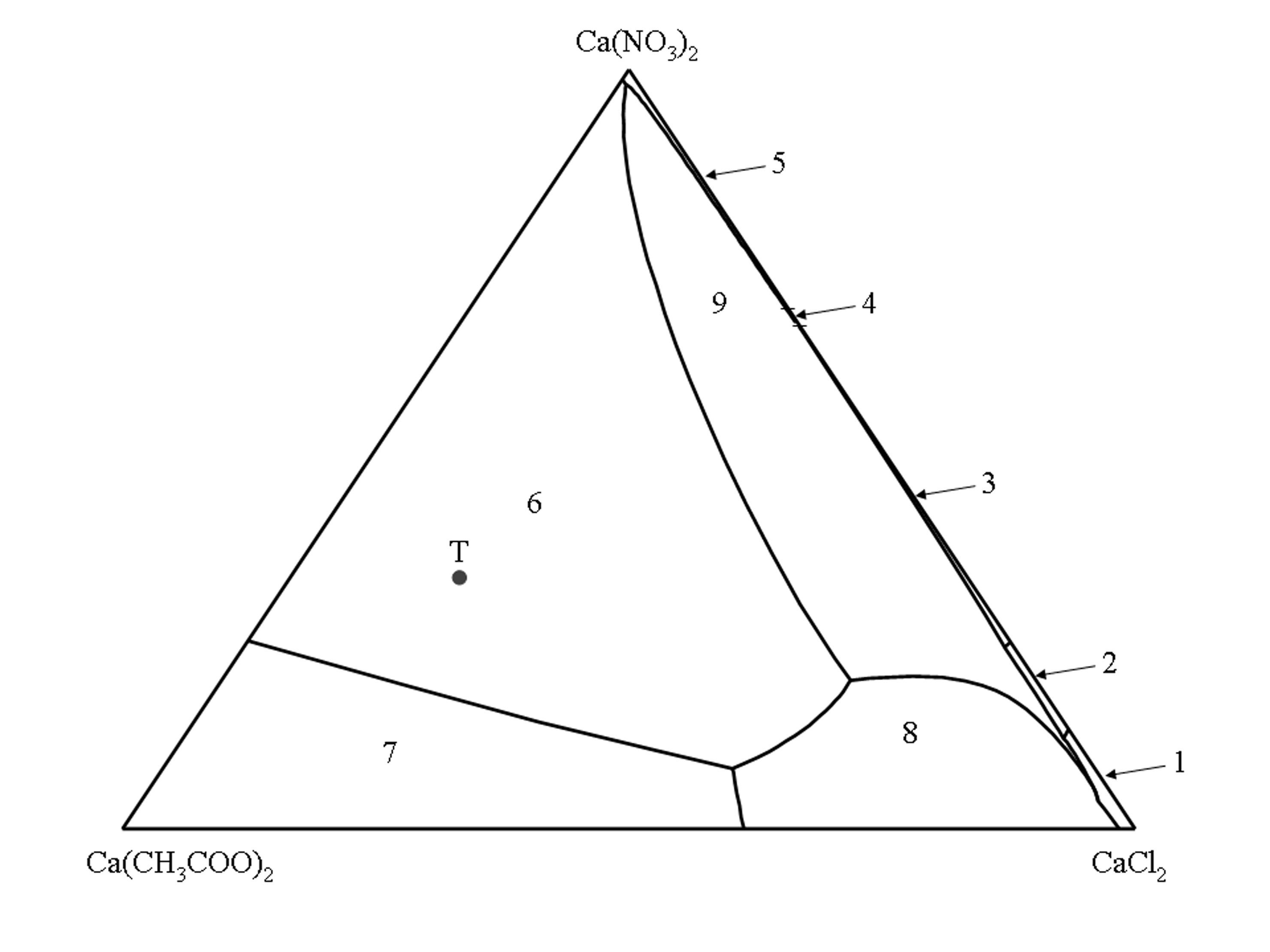
(1) CaCl2 • 6H2O, (2) CaCl2 • 4H2O, (3) CaCl(NO3) • 2H2O, (4) Ca(NO3)2 • 3H2O, (5) Ca(NO3)2 • 4H2O, (6) Ca2(CH3COO)3(NO3) • 2H2O, (7) Ca(CH3COO)2 • H2O, (8) Ca(CH3COO)Cl • 5H2O, (9) Ca3(CH3COO)3Cl(NO3)2 • 7H2O.
Punkt T im Phasendiagramm repräsentiert die Zusammensetzung des Tripelsalzes Thecotrichite (Ca3(CH3COO)3Cl(NO3)2 • 7H2O).
Das isotherme Phasendiagramm des quaternären Systems Ca(CH3COO)2–CaCl2–Ca(NO3)2–H2O (25°C)[Linnow:2007]Titel: Salt damage in porous materials: An RH XRD investigation
Autor / Verfasser: Linnow, Kirsten ist als Jännecke Projektion auf die wasserfreie Ebene abgebildet. Alle Lösungszusammensetzungen werden als Stoffmengenverhältnis von Ca(CH3COO)2, CaCl2 und Ca(NO3)2 angegeben. Die Ecken des Dreiecks repräsentieren die reinen Salze, die Seiten repräsentieren die drei ternären Randsysteme Ca(CH3COO)2–CaCl2–H2O, Ca(CH3COO)2–Ca(NO3)2–H2O und CaCl2–Ca(NO3)2–H2O und die innere Fläche repräsentiert alle Lösungszusammensetzungen an denen alle drei Salze beteiligt sind.
ist als Jännecke Projektion auf die wasserfreie Ebene abgebildet. Alle Lösungszusammensetzungen werden als Stoffmengenverhältnis von Ca(CH3COO)2, CaCl2 und Ca(NO3)2 angegeben. Die Ecken des Dreiecks repräsentieren die reinen Salze, die Seiten repräsentieren die drei ternären Randsysteme Ca(CH3COO)2–CaCl2–H2O, Ca(CH3COO)2–Ca(NO3)2–H2O und CaCl2–Ca(NO3)2–H2O und die innere Fläche repräsentiert alle Lösungszusammensetzungen an denen alle drei Salze beteiligt sind.
Die inneren Linien begrenzen die Stabilitätsfelder einer Salzphase. Die Stabilitätsfelder repräsentieren alle Lösungszusammensetzungen die bezüglich nur einer einzelnen Salzphase gesättigt sind, während die univarianten Linien die Lösungszusammensetzungen repräsentieren bei denen zwei Salzphasen im Gleichgewicht mit der Lösung stehen.
Gemäß der Gibbs´schen Phasenregel können im quaternären System maximal drei verschiedenen Salzphasen im Lösungsgleichgewicht miteinander existieren. Daraus folgt, dass es für jede mögliche Kombination von drei Salzphasen als Bodenkörper nur eine mögliche Zusammensetzung der gesättigten Lösung gibt. Diese Lösungszusammensetzungen werden durch die Schnittpunkte der univarianten Linien repräsentiert.
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Linnow:2007] | Linnow, Kirsten (2007): Salt damage in porous materials: An RH XRD investigation. Dissertation, Institut für Anorganische und Angewandte Chemie, Universität Hamburg, Webadresse |  |