Calciumchlorid: Unterschied zwischen den Versionen
Zur Navigation springen
Zur Suche springen
Keine Bearbeitungszusammenfassung |
|||
| Zeile 16: | Zeile 16: | ||
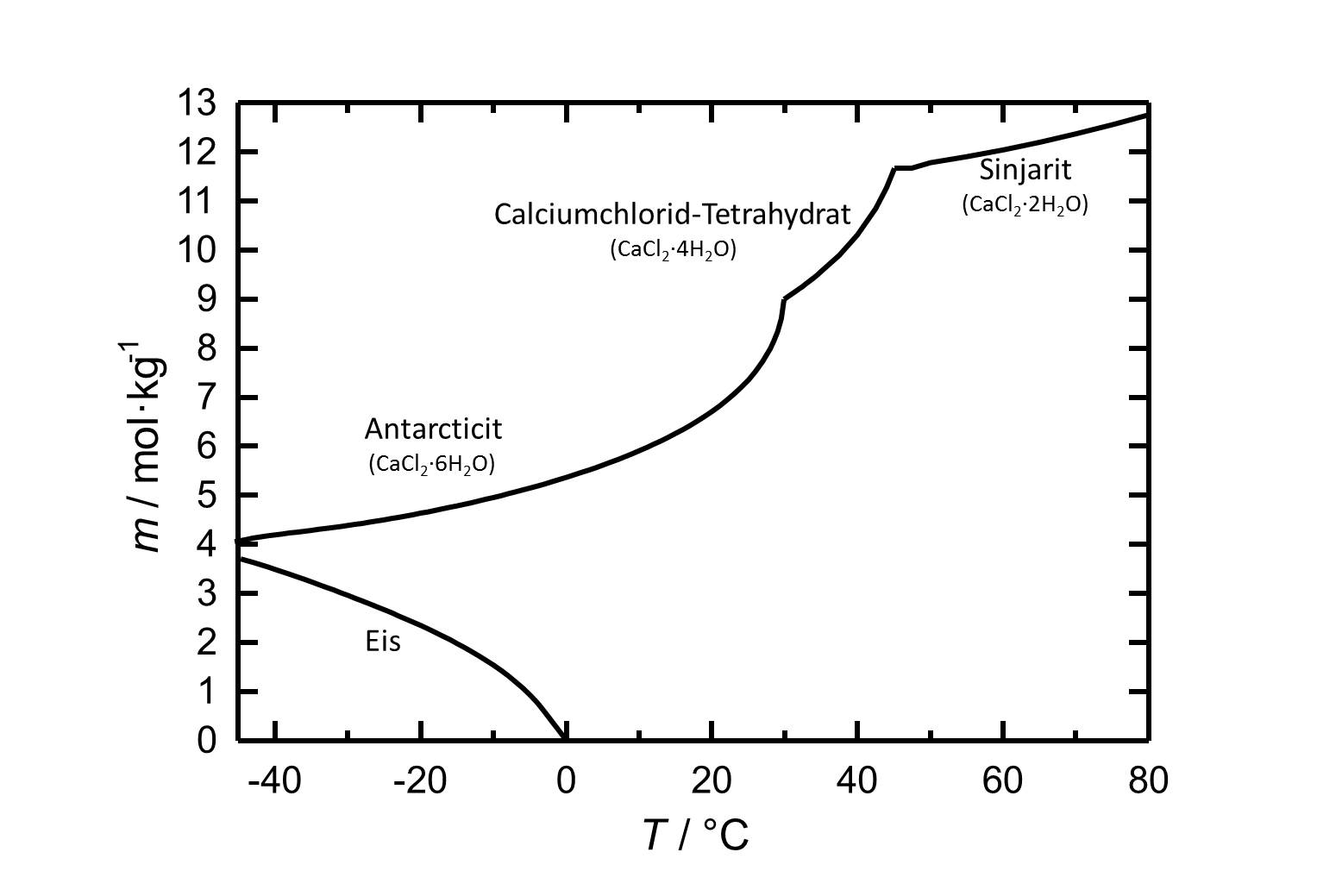
[[Image:L CaCl2 deu.jpg|thumb|right|320px|Abbildung 1: Löslichkeit von Calciumchlorid in Wasser, aufgetragen ist die Molalität ''m'' [n(CaCl<sub>2</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] | [[Image:L CaCl2 deu.jpg|thumb|right|320px|Abbildung 1: Löslichkeit von Calciumchlorid in Wasser, aufgetragen ist die Molalität ''m'' [n(CaCl<sub>2</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] | ||
Unter Standardbedingungen liegt das Hexahydrat des Calciumchlorids, [[Antarcticit]], vor. Das Salz weißt eine hohe Löslichkeit in Wasser auf, die mit steigernder Temperatur zunimmt. Die Dehydratisierung zum [[Calciumchlorid-Tetrahydrat]] erfolgt bei etwa 30 °C, die zu [[Sinjarit]] bei etwa 45 °C. | |||
==Hygroskopizität== | ==Hygroskopizität== | ||
Version vom 25. Februar 2015, 12:15 Uhr
Autor: Amelie Stahlbuhk
zurück zu Chloride
| Dieser Artikel wird gerade neu erstellt und ist noch nicht vollständig. |
Abstract[Bearbeiten]
Die verschiedenen Hydratstufen des Calciumchlorids sollen kurz vorgestellt werden, sowie ihr Verhalten bezüglich Löslichkeit und Hygroskopizität besprochen werden.
Hydratstufen[Bearbeiten]
Sinjarit: CaCl2•2H2O
Calciumchlorid-Tetrahydrat: CaCl2•4H2O
Antarcticit: CaCl2•6H2O
Lösungsverhalten[Bearbeiten]
Unter Standardbedingungen liegt das Hexahydrat des Calciumchlorids, Antarcticit, vor. Das Salz weißt eine hohe Löslichkeit in Wasser auf, die mit steigernder Temperatur zunimmt. Die Dehydratisierung zum Calciumchlorid-Tetrahydrat erfolgt bei etwa 30 °C, die zu Sinjarit bei etwa 45 °C.
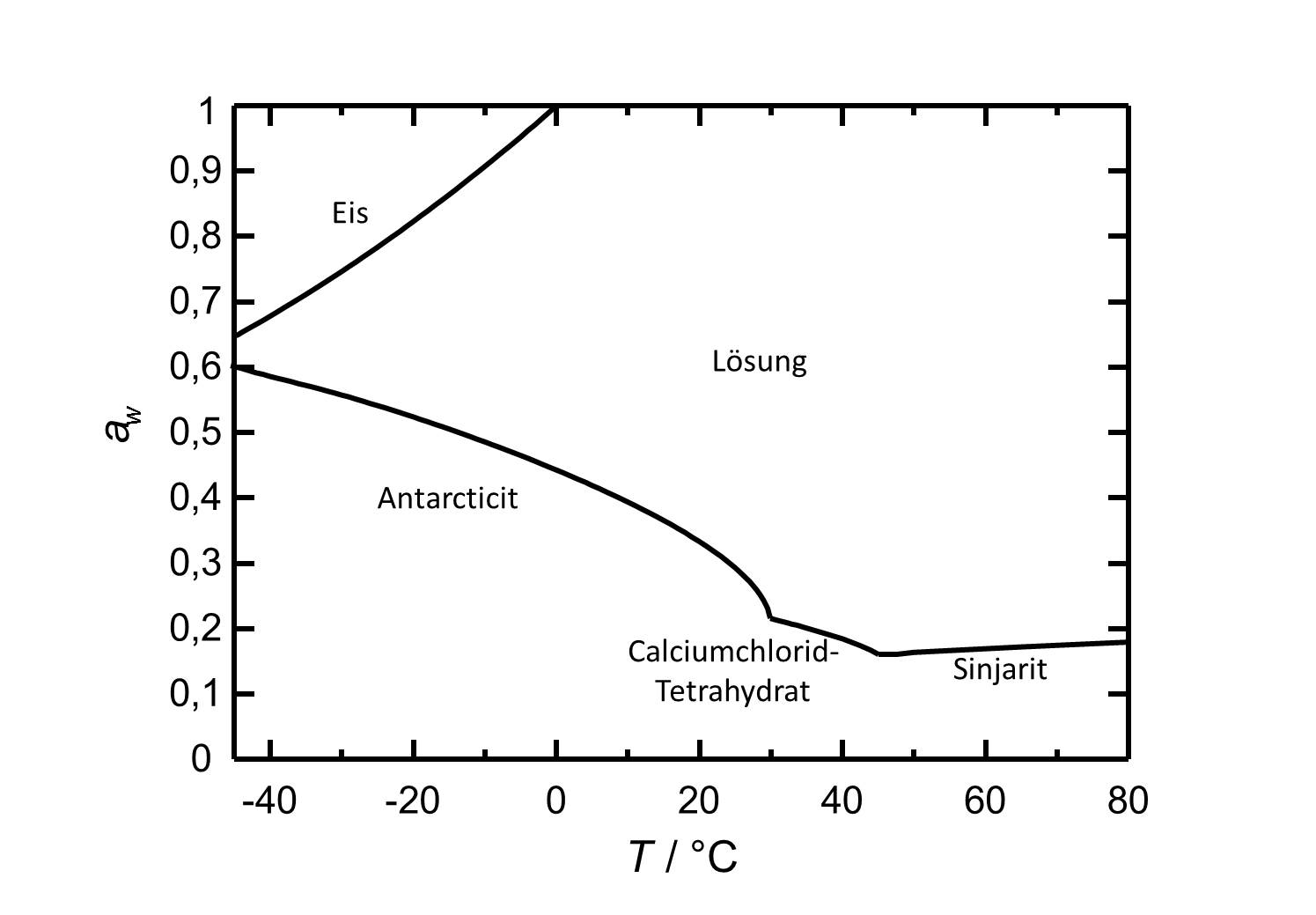
Hygroskopizität[Bearbeiten]
Einzelnachweise[Bearbeiten]
Literatur[Bearbeiten]
Es wurden keine Zitate im Artikel gefunden.