Thecotrichite: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 85: | Zeile 85: | ||
<br clear=all> | |||
== '''Phasendiagramm des quaternären System Ca(CH'''<sub>'''3'''</sub>'''COO)'''<sub>'''2'''</sub>'''–CaCl'''<sub>'''2'''</sub>'''–Ca(NO'''<sub>'''3'''</sub>''')'''<sub>'''2'''</sub>'''–H'''<sub>'''2'''</sub>'''O''' == | == '''Phasendiagramm des quaternären System Ca(CH'''<sub>'''3'''</sub>'''COO)'''<sub>'''2'''</sub>'''–CaCl'''<sub>'''2'''</sub>'''–Ca(NO'''<sub>'''3'''</sub>''')'''<sub>'''2'''</sub>'''–H'''<sub>'''2'''</sub>'''O''' == | ||
Version vom 9. August 2010, 07:35 Uhr
<accesscontrol>autor</accesscontrol>
<bibimport />
Autoren: Kirsten Linnov
zurück zu Organische Salze
| Thecotrichite | |
| [[Image:{{{bild}}}|300px]] | |
| Mineralogische Salzbezeichnung | Thecotrichite |
| Chemische Bezeichnung | |
| Trivialname | |
| Chemische Formel | Ca3(CH3COO)3Cl(NO3)2•7H2O |
| Hydratformen | |
| Kristallklasse | |
| Deliqueszenzfeuchte 20°C | |
| Dichte (g/cm³) | |
| Molvolumen | |
| Molgewicht | |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Brechungsindices | |
| Doppelbrechung | |
| Optische Orientierung | |
| Pleochroismus | |
| Dispersion | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | |
Abstract[Bearbeiten]
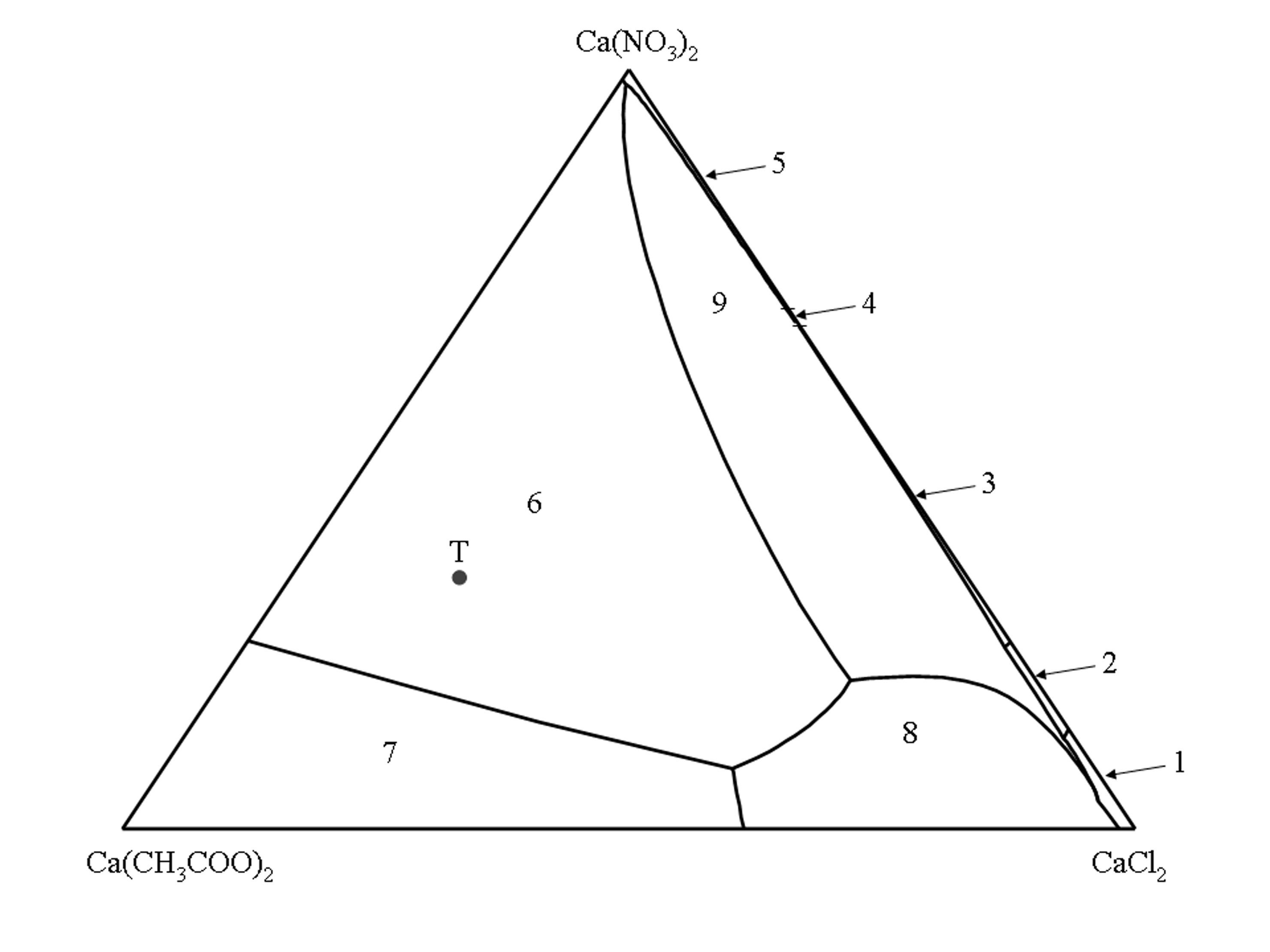
Phasendiagramm des quaternären System Ca(CH3COO)2–CaCl2–Ca(NO3)2–H2O[Bearbeiten]
Das isotherme Phasendiagramm des quaternären System Ca(CH3COO)2–CaCl2–Ca(NO3)2–H2O (25°C) ist als Jännecke Projektion auf die wasserfreie Ebene abgebildet. Alle Lösungszusammensetzungen werden als Stoffmengenverhältnis von Ca(CH3COO)2, CaCl2 und Ca(NO3)2 angegeben. Die Ecken des Dreiecks repräsentieren die reinen Salze, die Seiten repräsentieren die drei ternären Randsysteme Ca(CH3COO)2–CaCl2–H2O, Ca(CH3COO)2–Ca(NO3)2–H2O und CaCl2–Ca(NO3)2–H2O und die innere Fläche repräsentiert alle Lösungszusammensetzungen an denen alle drei Salze beteiligt sind.
Die inneren Linien begrenzen die Stabilitätsfelder einer Salzphase. Die Stabilitätsfelder repräsentieren alle Lösungszusammensetzungen die bezüglich nur einer einzelnen Salzphase gesättigt sind, während die univarianten Linien die Lösungszusammensetzungen repräsentieren bei denen zwei Salzphasen im Gleichgewicht mit der Lösung stehen.
Gemäß der Gibbs´schen Phasenregel können im quaternären System maximal drei verschiedenen Salzphasen im Lösungsgleichgewicht miteinander existieren. Daraus folgt, dass es für jede mögliche Kombination von drei Salzphasen als Bodenkörper nur eine mögliche Zusammensetzung der gesättigten Lösung gibt. Diese Lösungszusammensetzungen werden durch die Schnittpunkte der univarianten Linien repräsentiert.